Agenten zwischen Gut und Böse
Theorie des engen Wirtsspektrums von Phagen in Frage gestellt: Konsequenzen für die Phagentherapie?
Bakterienbefallende Viren könnten eines Tages Antibiotika ersetzen, weil sie präzise nur bestimmte Krankheitserreger angreifen. ETH-Forschende zeigen nun aber, das dem nicht immer so ist. Bedeutend ist dies, weil solche Viren auch Antibiotikaresistenzen übertragen können.
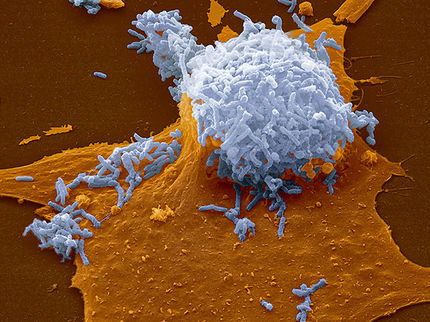
Mehrere Phagen gleichzeitig befallen während einem der Experimente eine Staphylokokken-Zelle. Gut möglich, dass einer davon ein Antibiotikum-Resistenzgen im Genom trägt.
Pauline Göller/ETH Zürich
Bakteriophagen, kurz Phagen, sind Viren, die ausschliesslich Bakterien befallen. Um einen bakteriellen Wirt zu kapern, heften sie sich zunächst an spezifische Moleküle auf dessen Zelloberfläche. Dann injizieren sie ihr Erbgut in die Bakterienzelle. Um die bakterielle Zellmaschinerie zur Produktion neuer Virenpartikel umzuprogrammieren, müssen Phagen zudem das Immunsystem des Zielbakteriums überlisten.
Die molekularen Eintrittspforten und das Immunsystem unterscheiden sich je nach Bakterium. Die gängige Meinung war daher, dass die meisten Phagen ein enges Wirtsspektrum haben, also nur eine einzelne Bakterienart oder sogar Unterart angreifen. Daher stammt auch die Idee, die natürlichen Bakterienkiller zur Behandlung von Infektionen einzusetzen – besonders, wenn die krankmachenden Bakterien Resistenzen gegen Antibiotika erworben haben.
Eine Studie unter der Leitung von Elena Gómez-Sanz, Postdoktorandin in der Gruppe von Martin Loessner, Professor für Lebensmittelmikrobiologie an der ETH Zürich, stellt die Theorie des engen Wirtsspektrums von Phagen nun aber in Frage. Phagen innerhalb der Bakteriengruppe der Staphylokokken befallen oft mehrere Arten gleichzeitig. Ihre Resultate veröffentlichten die Forschenden kürzlich in der Fachzeitschrift Nature Communications.
Das Ergebnis der Studie könnte unmittelbare Konsequenzen für die Phagentherapie haben, welche in der Schweiz noch nicht zugelassen ist, jedoch in Osteuropa schon lange angewandt wird. Phagen töten Bakterien nämlich nicht nur ab, sie können auch Antibiotika-Resistenzgene von einem Bakterium auf ein anderes übertragen. Durch ihr ungeahnt grosses Beuteschema könnten Phagen demnach Resistenzen viel weiter in der Umwelt verbreiten als bisher gedacht.
Viele neue Phagen aus Klärwasser isoliert
Der Mechanismus, mit dem Phagen Antibiotikaresistenzen unter Bakterien verbreiten können, ist bereits bekannt. Kurz: Wenn sich die Viren in den Bakterienzellen vermehren, packen sie nicht nur ihr eigenes Erbgut in neue Viruspartikel ein. In einigen Fällen schleusen sie genetisches Material vom befallenen Bakterium – so etwa ein Resistenzgen – in die Viruspartikel. Befällt ein solcher Viruspartikel dann ein neues Bakterium, kann es zur Resistenzübertragung kommen.
Bei den Staphylokokken ist diese Form des Gentransfers besonders gut untersucht. Diese Bakteriengruppe mit über 50 Arten besiedelt natürlicherweise nicht nur den Menschen, sondern auch Nutztiere und sie kommt auch in Gewässern vor. Der bekannteste Vertreter ist Staphylococcus aureus – eine Bakterienart, die natürlicherweise unsere Nase und die Haut besiedelt, sich jedoch jüngst zu einem gefährlichen multiresistenten Krankheitserreger entwickelt hat.
Phagen haben in der Evolution des heute häufigsten und am weitesten verbreiteten multiresistenten Erregers eine entscheidende Rolle gespielt, so die weit verbreitete Annahme. Es ist daher kaum verwunderlich, dass über 90 Prozent der für Staphylokokken bekannten Phagen auf Staphylococcus aureus zurückgehen. Meist wurden sie aus klinischen Proben isoliert.
«Wenn wir die Rolle von Phagen als Übertrager von Antibiotikaresistenzen beurteilen wollen, müssen wir jedoch das ganze Bild – nicht nur die Situation in der Humanmedizin – betrachten», sagt Gómez-Sanz.
Auf der Suche nach einer möglichst grossen Bandbreite natürlicher Phagen von Staphylokokken begaben sich die ETH-Forschenden in Kläranlagen. Denn: Hier treffen die unterschiedlichsten Bakterien sowie deren Phagen aufeinander – jene aus der menschlichen Mikrobioms, aus der Tierhaltung, aus Haushalten und der Industrie. Insgesamt 94 Phagen haben die Forschenden für ihre Studie aus Klärwasser isoliert.
Viren spannen riesiges Netzwerk für Gentransfer auf
In Laborversuchen bestimmten die Forschenden das natürliche Beuteschema der isolierten Phagen. Dazu liessen sie die Phagen auf verschiedene potentielle Wirtsbakterien los und untersuchten deren Infektionsmuster. Unter den insgesamt untersuchten 117 Bakterienstämmen befanden sich Vertreter aus 29 verschiedenen Staphylokokkus-Arten, Bakterien aus allen Lebensräumen, mit und ohne Antibiotikaresistenzen.
Das Resultat: Ein Phage befällt im Schnitt vier verschiedene Bakterienarten. Oder aus Sicht der Bakterien: Ein Staphylokokkus-Art kann durch «gemeinsame» Phagen durchschnittlich mit mehr als 17 anderen Arten Erbmaterial austauschen. «Dieses riesige Netzwerk zeigt auf, welch grossen Einfluss Phagen auf Bakteriengemeinschaften haben können», so Gómez-Sanz.
Die These des engen Wirtsspektrums habe sich wohl so lange gehalten, weil bisher kaum ähnliche Studien existieren, die die Infektiosität von Phagen über viele verschiedene Bakterienarten hinweg untersuchen, so die Mikrobiologin. Frühere Arbeiten waren oft nur auf klinisch relevanter Bakterienarten wie Staphylococcus aureus beschränkt. Gerade die Verbreitung von Antibiotikaresistenzen sollte jedoch dringend über einzelne Lebensräume hinaus untersucht werden, zeigt die vorliegende Studie.
Die Gesundheit des Menschen ist eng mit der Gesundheit von Tieren und der Umwelt verbunden», sagt Gómez-Sanz. So zeigen die neuen Erkenntnisse zum Netzwerk einzelner, natürlicher Phagen, dass Antibiotikaresistenzen von Bakterien des tierischen Mikrobioms über Phagen direkt an menschliche Krankheitserreger weitergegeben werden könnten. Dies unterstreicht die Wichtigkeit des modernen «One-Health-Ansatzes» beim Einsatz von Antibiotika.
Wie häufig Phagen Resistenzen übertragen, ist unklar
Wie häufig Phagen Antibiotikaresistenzen in der Natur tatsächlich übertragen, lässt sich mit Laborexperimenten bislang nur schwer abzuschätzen. Die vorliegende Studie trifft dennoch eine Annahme, welche der untersuchten Phagen besonders potente Überträger sind.
Bei 28 der 94 Phagen haben die ETH-Forschenden untersucht, wie häufig diese während ihrer Vermehrung in einem untersuchten Wirtsbakterium ein natürliches Resistenzgen aufnehmen. Die Aufnahmehäufigkeit variierte von 1 in 100 bis zu 1 in 10 Millionen Partikel.
Grund für diese grossen Unterschiede sind die unterschiedlichen Lebenszyklen und die Enzyme, die die Viren nutzen, um ihr Erbgut zu verpacken. «Einige sind ‹fehleranfälliger› als andere, packen also eher bakterielle Erbgut-Teile mit ein», erklärt Gómez-Sanz. Haben solche Phagen zusätzlich ein breites Wirtsspektrum, ist das Risiko einer Übertragung nochmals grösser.
Die Studienergebnisse seien für den therapeutischen Gebrauch von Phagen, wie die Autoren betonen. Positiv zu werten ist die Erkenntnis, dass Phagen ein breites Wirtsspektrum haben können. Das erleichtert ihr Einsatz gegen eine Vielzahl von krankmachenden Bakterien.
Allerdings muss man beim Einsatz von Phagen in der Medizin aufpassen, dass diese nicht zusätzlich als Überträger von Antibiotikaresistenzen fungieren. Daher sei es wichtig, dass medizinisch genutzte Phagen einen möglichst fehlerfrei funktionierenden Vermehrungsmechanismus besitzen.