Waffenruhe für resistente Keime
Saarbrücker Forscher entwickeln Wirkstoffkandidaten gegen Krankenhauskeim
Die zunehmende Ausbreitung resistenter Keime führt dazu, dass ehemals hochwirksame Antibiotika zur Behandlung von Infektionserkrankungen oftmals nicht mehr erfolgreich eingesetzt werden können. Um dieser Entwicklung entgegenzuwirken, hat das Team um Prof. Anna Hirsch vom Helmholtz-Institut für Pharmazeutische Forschung Saarland (HIPS) neue Wirkstoffkandidaten entwickelt, die dazu in der Lage sind, einen der wichtigsten Krankenhauskeime unschädlich zu machen.
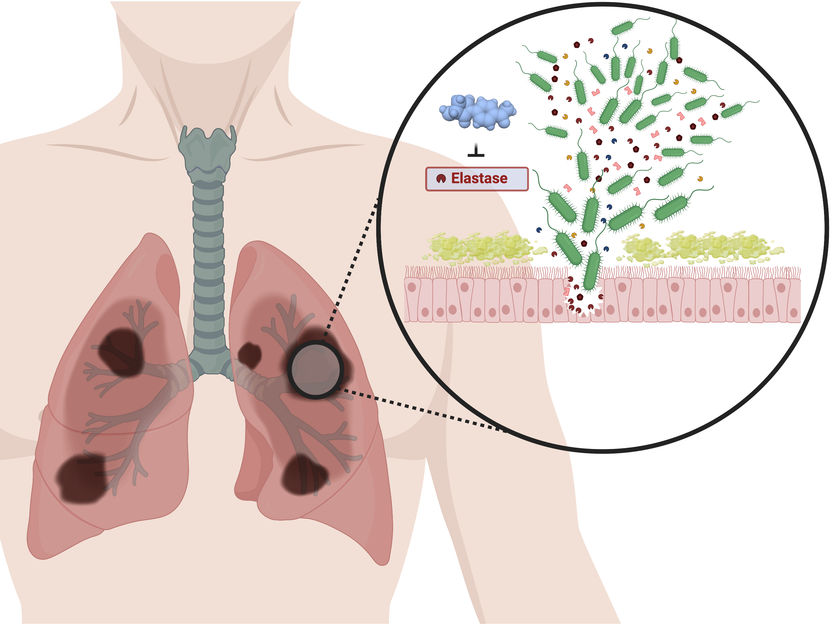
Die entwickelten Pathoblocker inaktivieren das Enzym LasB und entwaffnen somit den Krankheitserreger Pseudomonas aeruginosa.
© Alaa Alhayek/HIPS (created with biorender.com)
Der Krankenhauskeim Pseudomonas aeruginosa verursacht eine Vielzahl von Infektionserkrankungen: von Lungenentzündungen über Wund-, Augen- und Harnwegsinfektionen bis hin zur Sepsis. Besonders durch P. aeruginosa ausgelöste Lungenentzündungen stellen eine große Gefahr für Mukoviszdose- und Covid-19 Patienten während der künstlichen Beatmung dar. Verschärft wird die Bedrohung durch diesen Keim dadurch, dass zunehmend Varianten auftreten, welche gegen mehrere der konventionell eingesetzten Antibiotika resistent sind. Derzeit liegen in der EU bei etwa zehn Prozent der Infektionen mit P. aeruginosa Resistenzen gegen drei oder mehr Antibiotikaklassen vor – Tendenz steigend.
Um dem resultierenden Bedarf nach neuen Strategien und Behandlungsmöglichkeiten gerecht zu werden, haben Forscher des HIPS, einem Standort des Helmholtz-Zentrums für Infektionsforschung (HZI) in Zusammenarbeit mit der Universität des Saarlandes, einen erfolgversprechenden Ansatz entwickelt. Hierbei wird eine der wichtigsten „Waffen“ von P. aeruginosa entschärft: Ein Enzym namens LasB, das für den Abbau von menschlichem Gewebe verantwortlich ist und es dem Keim damit ermöglicht, besser den Ort der Infektion zu erreichen und sich dort einzunisten.
Wirkstoffe dieser Art werden auch als „Pathoblocker“ bezeichnet, da sie die Bakterien im Gegensatz zu Antibiotika nicht abtöten, sondern lediglich deren krankmachende Eigenschaften blockieren. Dies bietet den Vorteil, dass für den Menschen ungefährliche Bakterien nicht in Mitleidenschaft gezogen werden und es weniger häufig zur Entstehung von Resistenzen kommt. Im konkreten Fall kommt eine neu entwickelte Klasse von Wirkstoffen zum Einsatz, die direkt an LasB binden und dieses somit inaktivieren. Anna Hirsch, Leiterin der Abteilung Wirkstoffdesign und Optimierung am HIPS, sagt: „Da uns die dreidimensionale Molekülstruktur von LasB aus einer früheren Studie bestens bekannt war, konnten wir unsere Moleküle so entwerfen, dass sie bestmöglich zu ihrem Zielprotein passen und dieses effizient und spezifisch inaktivieren können. Das Ergebnis ist eine Reihe an Wirkstoffkandidaten, die dazu in der Lage sind, LasB 12-mal besser zu binden als bisherige Kandidaten. Das ist ein ausgezeichneter Ausgangspunkt für die weitere Entwicklung hin zum fertigen Medikament.“ Dass die entwickelten Moleküle das Potential haben, den Wirtsorganismus vor dem schädlichen Effekt von LasB zu schützen, zeigen erste Ergebnisse aus einem Modell mit Galleria mellonella-Larven. Kommen die Larven in Kontakt mit LasB, so überleben nur rund zehn Prozent. Unter dem Einfluss der Wirkstoffe aus dem Labor von Anna Hirsch, steigt dieser Wert auf über 60 Prozent.
Neben dem Wirkprinzip der entwickelten Substanzen handelt es sich auch bei deren Optimierung um einen innovativen Ansatz. „Üblicherweise beginnt man beim Design solcher Inhibitoren mit sehr kleinen Molekülen und erweitert diese dann schrittweise.“, sagt die Erstautorin der Studie, Cansu Kaya. „Bei der Analyse des Bindeverhaltens früherer Kandidaten ist uns aufgefallen, dass manchmal zwei dieser Moleküle gleichzeitig an LasB binden. Inspiriert von dieser Beobachtung, haben wir die beiden Fragmente anschließend so miteinander verknüpft, dass ihre räumliche Ausrichtung zueinander nicht beeinflusst wird. Diese als fragment linking bezeichnete Methode ist deutlich komplizierter als konventionelle Ansätze, bietet aber im Erfolgsfall einen deutlich höheren Aktivitätsgewinn in sehr kurzer Zeit. Wir hoffen, dass unsere Methode in Zukunft auch verwendet werden kann, um die Entwicklung von Wirkstoffen gegen andere Krankheiten zu beschleunigen.“
Prof. Rolf Müller, Geschäftsführender Direktor des HIPS und Leiter der Abteilung Mikrobielle Naturstoffe, sieht den entwickelten Ansatz als vielversprechende Ergänzung zur Entwicklung neuer Antibiotika: „Leider ist die Entwicklung neuer Antibiotika sehr langwierig, teuer und wird nur noch von wenigen Pharmafirmen unterstützt. Die entwickelten Substanzen bieten uns einen alternativen Ansatz, um das Problem der antimikrobiellen Resistenz angehen zu können. Da sich resistente Keime auch in Zukunft immer mehr ausbreiten werden, sind solche Wirkstoffkandidaten von unschätzbarem Wert.“
In Folgestudien sollen die beschriebenen Substanzen nun weiterentwickelt und für ihre Anwendung am Menschen optimiert werden. Bei diesem Vorhaben wird Anna Hirsch von der US-amerikanischen Förderorganisation CARB-X unterstützt: Diese fördert die Arbeiten auf diesem Gebiet seit Ende 2020 mit Fördergeldern in Höhe von 1,46 Millionen Euro.