Catch me if you can: Wie mRNA-Therapeutika in Zellen gelangen
Neue Erkenntnisse für Entwicklung von RNA-Therapeutika, mit denen eine effiziente Einbringung der RNA und eine geringere Dosierung erreicht werden kann
Forscher entdecken, wo und wie mRNA in eine Zelle gelangt, um dort genetische Informationen zu verändern oder zu übermitteln – ein zentraler Aspekt für die Entwicklung neuer Therapien.
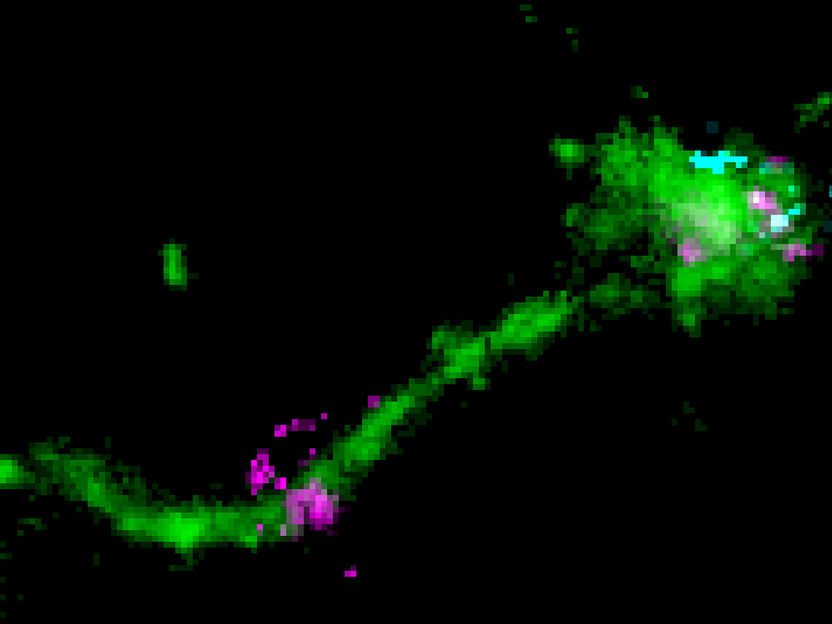
Ein LNP befindet sich auf einem langen endosomalen Tubulus (grün), zusammen mit einem senkrecht verlaufenden mRNA-Signal (cyan). Das Bild zeigt wahrscheinlich ein Entkommen von mRNA (lila).
Marino Zerial / MPI-CBG
In den letzten Jahren hat sich die Ribonukleinsäure (RNA) in ein vielversprechendes Molekül für die Entwicklung neuer Therapien entwickelt. Die RNA kopiert die genetische Information, die in unserem Erbgut, der DNA, enthalten ist, und dient dann als Vorlage für den Aufbau von Proteinen, den Bausteinen des Lebens. Aber die Einbringung von RNA in Zellen ist nach wie vor eine große Herausforderung für die Entwicklung neuer Therapien für eine Vielzahl von Krankheiten. Forschende des Max-Planck-Instituts für molekulare Zellbiologie und Genetik (MPI-CBG) in Dresden haben gemeinsam mit Forschenden des globalen biopharmazeutischen Unternehmens AstraZeneca untersucht, wo und wie mRNA in die Zelle gelangt. Diese Ergebnisse liefern neue Erkenntnisse für die Entwicklung von RNA-Therapeutika, mit denen eine effiziente Einbringung der RNA und eine geringere Dosierung erreicht werden kann.
Die DNA enthält die genetischen Informationen, die für die Entwicklung und Erhaltung von Leben erforderlich sind. Diese Informationen werden durch Boten-RNA (mRNA) weitergegeben, um Proteine zu bilden. mRNA-basierte Therapeutika könnten den bislang unerfüllten Wunsch nach Heilung für eine Vielzahl von Erkrankungen, darunter Krebs und Herz-Kreislauf-Erkrankungen, erfüllen. mRNA kann in Zellen eingebracht werden, um die Herstellung, den Abbau oder die Veränderung eines bestimmten Proteins auszulösen. Dies ist bei anderen Ansätzen bisher nicht möglich. Eine der größten Herausforderungen bei dieser Methode besteht darin, die mRNA in die Zelle zu bringen, damit sie zur Herstellung eines Proteins übersetzt werden kann. mRNA kann in Lipid-Nanopartikel (LNPs) – kleine Fetttröpfchen – verpackt werden, die die mRNA schützen und in die Zellen transportieren. Dieser Prozess ist jedoch nicht einfach, denn die mRNA muss auch die intrazelluläre Membran überwinden, bevor sie ihren Wirkungsort im Zellinneren, das Zytoplasma, erreichen kann.
Die Forschenden im Team von MPI-CBG-Direktor Marino Zerial sind Experten dafür, zelluläre Eintrittswege und Moleküle in der Zelle, wie zum Beispiel mRNA, mit hochauflösenden Mikroskopen sichtbar zu machen. Sie arbeiteten mit Wissenschaftlern von AstraZeneca zusammen, die den Forschern Prototypen von Lipid-Nanopartikeln zur Verfügung stellten, die sie für therapeutische Ansätze entwickelt hatten. Mit den Lipid-Nanopartikeln konnten die Forschenden die mRNA im Zellinneren verfolgen. Die Studie wurde im Journal of Cell Biology veröffentlicht.
„Um in die Zelle zu gelangen, muss mRNA einen langen Weg zurücklegen. In den fettigen LNP-Tröpfchen eingeschlossen, muss sie zunächst erst einmal in die Zelle hinein“, erklärt Marino Zerial. „Die LNPs erreichen die Zelloberfläche, wo sie an Rezeptoren binden. Anschließend werden sie in Endosomen aufgenommen, spezielle Organellen, die von einer Membran umschlossen sind. Zu diesem Zeitpunkt befindet sich die mRNA innerhalb der Zelle, ist aber von zwei Barrieren umgeben: dem Fetttröpfchen und der Endosomen-Membran. Die Herausforderung für die mRNA besteht darin, beide Barrieren zu überwinden, um in das Zytoplasma zu gelangen, wo sie als Vorlage für die Herstellung von Proteinen dient. Wir wissen, dass nur ein winziger Bruchteil der mRNA-Moleküle in das Zytoplasma entweichen kann.“ Eingebrachte Frachtmoleküle, wie die LNPs, werden zunächst zu „frühen“ Endosomen transportiert. Dabei handelt es sich um zelluläre Logistikzentren, die die Frachtmoleküle an verschiedene Ziele in der Zelle verteilen. Sie recyceln die Moleküle entweder und bringen sie zur Zelloberfläche zurück oder bauen sie in späten Endosomen und Lysosomen ab. Bisher ging man davon aus, dass die mRNA aus den späten Endosomen entkommt, indem sie deren stark säurehaltigen Inhalt dazu nutzt, die Membran zu überwinden. „Mit Einzelmolekül-Mikroskopiertechniken“, erklärt Prasath Paramasivam, der Erstautor der Studie, „konnten wir zum ersten Mal die mRNA im LNP innerhalb der Endosomen der Zellen sichtbar machen. Wir konnten auch beobachten, wie die mRNA aus den röhrenförmigen der nur leicht sauren ‚frühen‘ Recycling-Endosomen entweicht.“ Zerial ergänzt: „Unsere Ergebnisse deuten darauf hin, dass die Weiterleitung der LNP-mRNA an späte Endosomen kontraproduktiv ist und die Zelltoxizität erhöht.“ Diese Ergebnisse ermöglichen es, den Mechanismus, mit dem mRNA aus den Endosomen entkommt, genauer zu verstehen.
Marino Zerial fasst zusammen: „Das LNP-Transportsystem für mRNA benötigt aufgrund der geringen Effizienz, mit der die mRNA aus den Endosomen entkommen kann, eine hohe Dosierung. Wenn wir wissen, wohin die mRNA transportiert wird und wie sie den Endosomen entkommen kann, können wir bessere Transportmittel für eine effizientere Freisetzung bei geringerer Dosierung entwickeln. Wir können das mRNA-Transportsystem so verbessern, dass es für viele therapeutische Anwendungen, zum Beispiel zur Behandlung von Krebs, eingesetzt werden kann.“
Originalveröffentlichung
Prasath Paramasivam, Christian Franke, Martin Stöter, Andreas Höijer, Stefano Bartesaghi, Alan Sabirsh, Lennart Lindfors, Marianna Yanez Arteta, Anders Dahlen, Annette Bak, Shalini Andersson, Yannis Kalaidzidis, Marc Bickle, and Marino Zerial; "Endosomal escape of delivered mRNA from endosomal recycling tubules visualized at the nanoscale"; J Cell Biol; 2021: e202103003




















































