Wie Proteine verklumpen
Molekulare Mechanismen bei der Aggregation von Proteinen in membranlosen Organellen
Was passiert, wenn Zellen unter langanhaltendem Stress stehen? Proteine verhalten sich atypisch, stellen den Dienst ein, können verklumpen und schließlich der gesamten Zelle schaden. Welche Prozesse dazu führen, haben Forschende der Technischen Universität Braunschweig und der Université Paris untersucht. Im Mittelpunkt stand dabei ein Protein, das mit erblich bedingter ALS in Verbindung gebracht wird. Können die molekularen Prozesse besser verstanden werden, könnte an neuartigen Therapieansätzen für neurodegenerativen Krankheiten gearbeitet werden. Die Ergebnisse der Forschungsarbeit sind im Magazin „Journal of the American Chemical Society“ erschienen.
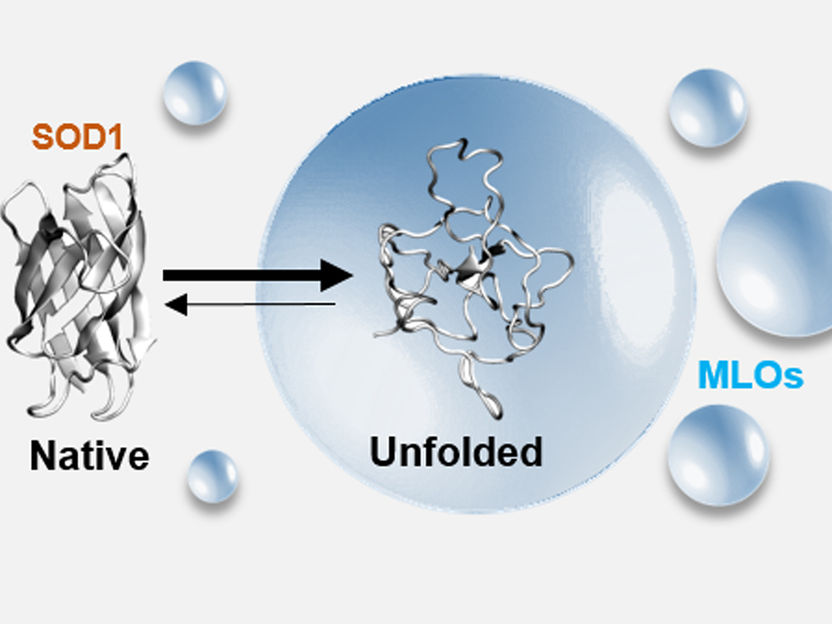
Was passiert, wenn die Zelle unter Stress steht: Es kommt zur Entfaltung von Proteinen (hier: Variante des SOD1-Proteins) und deren Anreicherung und Verklumpung in sogenannten membranlosen Organellen (MLO).
Nirnay Samanta, Sara S. Ribeiro/TU Braunschweig
Proteine sind die wichtigsten molekularen Maschinen der Zelle, die an allen lebensnotwendigen zellulären Prozessen beteiligt sind. Lange wurden Zellen als “bags full of proteins” betrachtet, wobei die Unterteilung der Zellbestandteile durch membranbegrenzte Organellen erfolgt. Beispiele für diese membranbegrenzten Organellen sind Zellkerne und Mitochondrien, die “Kraftwerke der Zelle”. Die Forschung der letzten fünf Jahre hat jedoch vermehrt gezeigt, dass sich die Proteine innerhalb solcher “bags” zusätzlich in membranlosen Organellen (MLOs) organisieren können.
Die Bildung dieser MLOs beruht auf Flüssig-Flüssig-Phasentrennung, ist also vergleichbar mit der Bildung von Öltröpfchen in Wasser. Dies ermöglicht den Zellen, verschiedene, voneinander getrennte chemische Umgebungen zu schaffen, in denen beispielsweise molekulare Prozesse nun sehr effizient ablaufen können.
Einige dieser MLOs werden gebildet, um der Zelle bei der Bewältigung von Stress zu helfen. Auf diese Weise stellen MLOs sicher, dass die funktionelle Form der Proteine erhalten bleibt und damit das Überleben der Zelle gesichert ist. Wenn allerdings die Zelle über einen längeren Zeitraum hinweg starken Belastungen ausgesetzt ist, beispielsweise im Zuge einer Erkrankung, funktioniert dieser Mechanismus unter Umständen nicht mehr. Proteine verklumpen innerhalb der MLOs, können ihre Funktion nicht mehr wahrnehmen oder schaden sogar der Zelle. Diese Prozesse werden mit verschiedenen neurodegenerativen Krankheiten wie Amyotrophe Lateralsklerose (ALS), Alzheimer und Parkinson in Verbindung gebracht.
„Ziel unserer Forschung ist es, die molekularen Mechanismen zu verstehen, die der Verklumpung von Proteinen in MLOs zugrunde liegen“, sagt Professor Simon Ebbinghaus vom Institut für Physikalische und Theoretische Chemie an der TU Braunschweig.
In der publizierten Forschungsarbeit wurde im Speziellen das Protein Superoxid-Dismutase 1 (SOD1) untersucht. SOD1 ist ein Enzym, das mit erblich bedingter ALS in Verbindung gebracht wird. In verschiedenen Experimenten und Computer-Simulationen wurden die Schritte bis zur Verklumpung analysiert. „Wir haben gezeigt, dass die anfänglichen Verklumpungsschritte, die Destabilisierung einzelner SOD1 Proteine, bereits eine entscheidende Rolle spielen. SOD1-Proteine, die mit ALS in Verbindung stehende Mutationen aufweisen, reichern sich so schnell in MLOs an. Wir hoffen, durch diese neuartigen Erkenntnisse Ansatzpunkte für neuartige therapeutischer Strategien gegen schwerwiegende neurodegenerative Erkrankungen zu liefern. Unsere zukünftige Forschung wird weiterhin in diese Richtung gehen“, sagt Professor Ebbinghaus.
Originalveröffentlichung
Meistgelesene News
Originalveröffentlichung
Samanta N, Ribeiro SS, Becker M, Laborie E, Pollak R, Timr S, Sterpone F & Ebbinghaus S; "Sequestration of Proteins in Stress Granules Relies on the In-Cell but Not the In Vitro Folding Stability"; J. Am. Chem. Soc.; 2021
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Antibody Stabilizer von CANDOR Bioscience
Protein- und Antikörperstabilisierung leicht gemacht
Langzeitlagerung ohne Einfrieren – Einfache Anwendung, zuverlässiger Schutz

DynaPro NanoStar II von Wyatt Technology
NanoStar II: DLS und SLS mit Touch-Bedienung
Größe, Partikelkonzentration und mehr für Proteine, Viren und andere Biomoleküle

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte

Könnten neue Krebsmedikamente aus Kartoffeln und Tomaten gewonnen werden? - Künftige Krebsmedikamente könnten eines Tages aus Glykoalkaloiden formuliert werden, die in Pflanzen der Gattung Solanum vorkommen
Das Navi im Spermienschwanz: Proteine im Zick-Zack-Muster halten Spermien auf Kurs - Bewegung in 4D mikroskopisch untersucht
Pfizer greift nach Generikahersteller Teuto aus Brasilien
QIAGEN übernimmt spanisches Diagnostik-Start-up - QIAGEN erzielt Einigung über den Kauf von STAT-Dx
Mehr Umsatz in der Industrie: Zeichen stehen auf Erholung
Coelom

KI ermittelt Zeitpunkt von Schlaganfällen - Algorithmus für besonders exakte Beurteilung von Hirnschäden

Regelmäßiger Verzehr von Walnüssen könnte die kognitive Entwicklung von Jugendlichen fördern und zu ihrer psychologischen Reifung beitragen - Abschluss einer weltweit führenden Studie in diesem Bereich unter der Leitung des IISPV und in Zusammenarbeit mit ISGlobal und dem medizinischen Forschungsinstitut Hospital del Mar (IMIM)
Bursa_Fabricii
Brutdauer