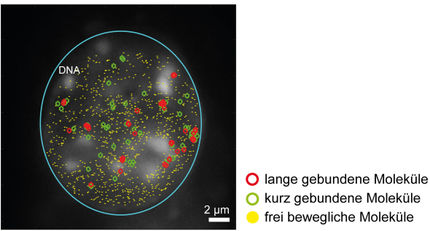
Betriebsanweisung für die Genregulation
Wie viel gewebespezifische Information ist in Enhancer-Sequenzen enthalten?
Woher wissen Zellen, wann sie welches Gen aktivieren müssen? Diese Information muss in der Sequenz der DNA verschlüsselt sein – wie genau, ist immer noch unklar. Forschende haben nun ausgelotet, welche Informationen aus Sequenzdaten extrahiert werden können, um vorherzusagen, welches Gen in welchem Gewebe aktiv ist.
Symbolbild
Unsplash
Ein guter Erzähler weiß genau, mit welchen Anekdoten die Figuren seiner Geschichte zum Leben erwachen. Indem es die richtige Story zur richtigen Zeit erzählt, schafft es unser Genom schafft sogar, für jede Zelle unseres Körpers einen individuellen Lebensweg zu zeichnen. So entstehen hunderte verschiedene Zelltypen mit typischen Lebensgeschichten.
Der Code, der dieses Drehbuch des Lebens steuert und dafür Gene nacheinander an- und abschaltet, ist über das gesamte Erbgut verstreut. Insbesondere DNA-Abschnitte namens „Enhancer“ (engl. für „Verstärker“) spielen in diesem Prozess eine herausragende Rolle. Sie ziehen Transkriptionsfaktor-Proteine an, die Gene anschalten und deren Aktivität also in gewisser Weise „verstärken“. Nicht selten sind diese Erbgutabschnitte weit von dem Gen entfernt, das sie aktivieren.
Die Forscher Philipp Benner und Martin Vingron vom Max-Planck-Institut für molekulare Genetik (MPIMG) wollten herausfinden, wann und wie stark Gene in verschiedenen Zelltypen und embryonalen Geweben der Maus aktiviert werden.
Mit einer Reihe von statistischen und bioinformatischen Methoden identifizierten die Wissenschaftler mehrere hundert gewebespezifische DNA-Teilsequenzen oder „Codewörter“ in Enhancern, die Transkriptionsfaktoren steuern. Damit bestätigten sie nicht nur bereits aus anderen Studien bekannte Sequenzen, sondern identifizierten auch viele neue. Die Ergebnisse wurden in mehreren Artikeln in den Fachzeitschriften NAR Genomics and Bioinformatics und Journal of Computational Biology veröffentlicht.
Eine theoretische Modellrechnung
„Momentan geht man davon aus, dass alle Informationen in der DNA-Sequenz enthalten sind, einschließlich der Informationen für bestimmte Zelltypen, Gewebe und Organe“, sagt Martin Vingron, Direktor am MPIMG. Gemäß der vorherrschenden Theorie erkennen die Transkriptionsfaktoren bestimmte „Codewörter“ in den Enhancern-Sequenzen, die für einen bestimmten Zelltyp charakteristisch sind. Das ermöglicht es dem Genom zu den richtigen Kapiteln zu springen, um die Lebensgeschichte der Zelle weiter zu spinnen. „Wir wollten sehen, wie weit wir mit diesem Denkansatz kommen und seine Grenzen ausloten“, sagt Vingron.
Die Forscher entwickelten ein Programm, das diese gewebespezifischen Codewörter in Sequenzdaten anhand statistischer Merkmale erkennt. Dafür fütterten sie das Programm zunächst mit vorhandenen Sequenzierungsdaten von acht unterschiedlichen Geweben der embryonalen Maus, wie zum Beispiel Herz, Lunge, Gehirn oder Leber. So lernte das Programm, welcher Enhancer in welchem Gewebe aktiv ist.
Aus Daten werden Vorhersagen
Durch den Vergleich der Daten verschiedener Gewebe lernte das Programm dann die Sequenzmuster in Enhancern zu erkennen, die für bestimmte Gewebe charakteristisch sind.
Dies verriet den Forschern, welche zelltypspezifische regulatorische Information tatsächlich in der DNA-Sequenz von Enhancern enthalten ist, erklärt Philipp Benner, Postdoktorand in Vingrons Labor: „Je besser unser Algorithmus einen bestimmten Enhancer klassifizieren kann, desto mehr Informationen enthält dieser auch über die Gewebe- oder Zelltypen, für die er verantwortlich ist.“
Die statistischen Klassifikatoren des Programms spucken sodann auch die DNA-Teilsequenzen aus, die der zelltypspezifischen Genaktivierung zugrunde liegen. Tatsächlich fand Benner neben zahlreichen bereits bekannten mehrere hundert neue dieser „Codewörter“.
„Insgesamt haben wir ein leistungsfähiges Modell entwickelt, dessen Ergebnisse sich leicht interpretieren lassen, was ein großer Vorteil ist“, sagt Benner.
Die Grenze ist fast erreicht
„Mit unseren ausgeklügelten Methoden gelingen uns vielversprechende Vorhersagen, die aber bei weitem nicht perfekt sind“, sagt Vingron. „Alles deutet darauf hin, dass wir den zelltypspezifischen Regulationscode noch immer nur unvollständig verstehen.“
Eine mögliche Erklärung: In Wirklichkeit sind nicht alle benötigten Informationen in der DNA-Sequenz von Enhancern enthalten, sondern an anderen Stellen im Genom verteilt. Einige Querverweise im Geschichtenbuch des Genoms könnten sich sogar in anderen regulatorischen Sequenzen verstecken, wie etwa in Promotorregionen, die sich in unmittelbarer Nähe zum eigentlichen Gen befinden.
Originalveröffentlichung
Benner, Philipp; "Computing leapfrog regularization paths with applications to large-scale k-mer logistic regression"; Journal of Computational Biology; 28.6 (2021): 560-569.
Benner, Philipp, and Martin Vingron; "Quantifying the Tissue-Specific Regulatory Information within Enhancer DNA Sequences"; NAR Genomics and Bioinformatics; 3.4 (2021).
Benner, Philipp, and Martin Vingron; "ModHMM: A modular supra-Bayesian genome segmentation method"; Journal of Computational Biology; 27.4 (2020): 442-457.