Das Pangenom – Schlüssel zu neuen Therapien
Genetische Vielfalt eröffnet neue Wege zur Behandlung lebensbedrohlicher Krankheiten
Aspergillus fumigatus ist ein in der Umwelt weit verbreiteter Pilz. Er verursacht bei Menschen lebensbedrohliche Infektionen, während eng verwandte Pilzarten harmlos sind. Ein internationales Forscherteam hat nun die große genetische Vielfalt des Erregers genauer unter die Lupe genommen.
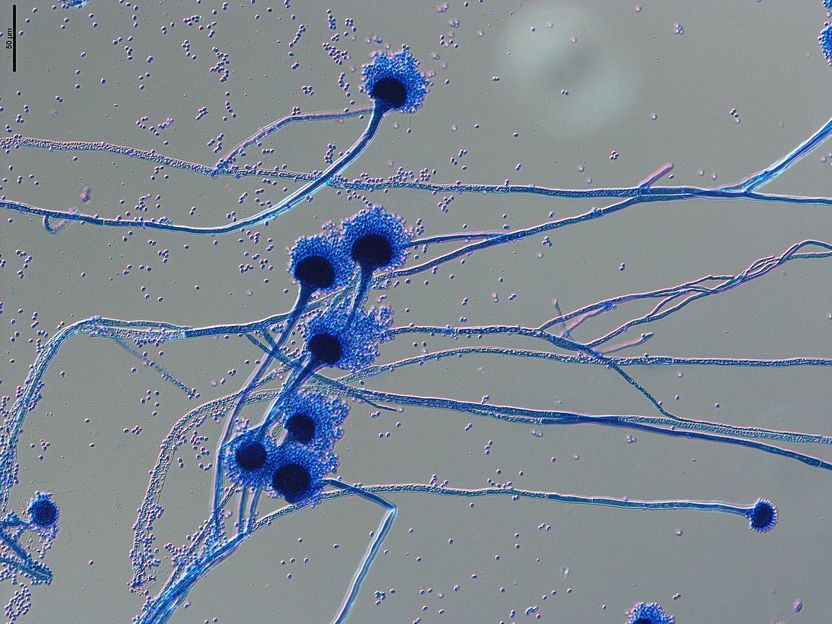
Mikroskopische Aufnahme von Sporenträgern des human-pathogenen Pilzes Aspergillus fumigatus. Die als Konidien bezeichneten Sporen mit einem Durchmesser von 1-2 Mikrometern werden über die Luft verbreitet und gelangen leicht in unsere Atemwege, wo sie bei immungeschwächten Personen schwere Infektionen auslösen können.
Grit Walther/Leibniz-HKI
Gefährliche Pilzinfektionen
Der Pilz Aspergillus fumigatus verursacht weltweit bei mehr als 300.000 Menschen pro Jahr schwere Infektionen. Insbesondere bei immungeschwächten Patienten endet eine Infektion mit Aspergillus fumigatus in bis zu 50% der Fälle tödlich. Behandelt werden diese Krankheiten meist mit sogenannten Triazol-Antimykotika. Im Laufe der Jahre haben Resistenzen gegen diese Medikamente immer weiter zugenommen. Hinzu kommt, dass die Sterblichkeitsrate bei diesen medikamentenresistenten Infektionen um bis zu 25% höher ist. Außerdem ist bei ca. 30% der resistenten Varianten der Resistenzmechanismus unbekannt. Folglich ist es umso komplizierter diese Art von Infektionen zu identifizieren und angemessen zu behandeln.
„Trotz dieser hohen Zahl von Infektionen pro Jahr fehlte bisher eine detaillierte Untersuchung der genomischen Vielfalt sowohl in klinischen Proben als auch in Isolaten aus der Umwelt. Insbesondere galt es für uns herauszufinden, welche Bedeutung diese genetische Vielfalt für den Verlauf der Infektion und die Entwicklung von Resistenzen gegen Antimykotika hat“, erklärt Gianni Panagiotou, Leiter der Forschungsgruppe Systembiologie und Bioinformatik am Leibniz-Institut für Naturstoff-Forschung und Infektionsbiologie – Hans-Knöll-Institut in Jena (Leibniz-HKI). Die Forscher sind sich sicher, dass die innerartliche genetische Diversität der Erreger für die Infektion auch eine wichtige Rolle spielt.
Das Pangenom – genetische Vielfalt erforscht
In seiner Studie sequenzierte und analysierte das Team, dem Forschende aus Jena, Würzburg und Hongkong angehören, eine große Anzahl von Genomen dieses weit verbreiteten Schimmelpilzes, darunter Stämme aus der Umwelt sowie klinische Proben. Diese Fülle an genomischen Informationen ergab, dass sich die verschiedenen Mitglieder der Spezies hinsichtlich ihrer Gene erheblich unterscheiden. Die Autoren definierten damit auch den gesamten Genbestand der Art, das sogenannte Pangenom, das die genetische Bandbreite von Aspergillus fumigatus umfasst. Dabei zeigte sich, dass reichlich zwei Drittel der genetischen Information sogenannte Kern-Gene umfasst, die in allen Isolaten vorkommen. Das verbleibende knappe Drittel beinhaltet hingegen akzessorische Gene, die nicht bei allen Isolaten zu finden sind. Sie sind demzufolge für das Wachstum des Pilzes entbehrlich, könnten aber eine noch unentdeckte Rolle für den Pilz in der Umwelt und bei der Infektion des Menschen spielen.
Eine besondere genetische Linie verursacht die meisten Infektionen
Im Vergleich der Genome aus Umwelt- und Patientenproben stellte sich heraus, dass eine bestimmte genetische Linie innerhalb der Art Aspergillus fumigatus mit größerer Wahrscheinlichkeit Infektionen beim Menschen verursacht. Die Genome dieser Gruppe wiesen besondere Merkmale auf, beispielsweise codierten sie für mehr Transmembrantransporter, eisenbindende Proteine und Enzyme des Grundstoffwechsels. Solche besonderen genetischen Merkmale sind als potenzielle Angriffspunkte für neue Wirkstoffe interessant, da sie eine Rolle für das Überleben des Pilzes in der menschlichen Lunge spielen könnten.
Außerdem identifizierten die Forscherinnen und Forscher in einer „genomweiten Assoziationsstudie“ kleine genetische Unterscheide zwischen den Isolaten. Bestimmte Abweichungen in der DNA-Sequenz traten in klinischen Isolaten statistisch deutlich häufiger auf als in Umwelt-Isolaten. Mit dieser Methode identifizierte das Team drei Gene, die in noch unbekannter Weise mit der Triazol-Resistenz in Verbindung stehen. „Hier sehen wir ebenfalls vielversprechende Ziele für künftige Therapieoptionen. Unsere Aufmerksamkeit gilt daher dem weiteren Studium derjenigen Gene und Proteine, die mit bislang unentdeckten Resistenzmechanismen im Zusammenhang stehen“, sagt Amelia E. Barber, Erstautorin der Studie und Leiterin der Nachwuchsgruppe Fungal Informatics am Leibniz-HKI.
Hoffnung für neue Therapieansätze
Die Ergebnisse ihrer bioinformatischen Analysen stellen die Autoren in der jüngsten Ausgabe des Fachjournals Nature Microbiology vor. Ihre globale Sicht auf das genetische „Instrumentarium“ von Aspergillus fumigatus weist dabei den Weg zu möglichen neuen Therapieansätzen. So kommen solche Gene und Signalwege, die in allen Vertretern der Art vorhanden sind, als gute therapeutische Ziele in Betracht. Hingegen wäre es ungünstig, mit einem neuen Medikament auf ein Gen abzuzielen, das nur in 90% der Vertreter des Pilzes vorkommt, während 10% der Erreger nicht betroffen sind.
Die Studie führt uns auch vor Augen, dass wir mit der genetischen Diversität innerhalb einer Art stets eine Momentaufnahme von fortwährenden Evolutionsprozessen betrachten. Die genetische Ausstattung des untersuchten Pilzes unterliegt durch intensive Auseinandersetzung mit seiner Umwelt einer hohen Dynamik und kann über längere Zeiträume hinweg zur Aufspaltung in stärker spezialisierte (Unter-)Arten führen.
Für ihre Arbeiten konnten sich die Forscherinnen und Forscher auf die Zusammenarbeit in großen Forschungsverbünden stützen. Den Zugang zu den klinischen Isolaten ermöglichte das am Leibniz-HKI angesiedelte Nationale Referenzzentrum für invasive Pilzerkrankungen, das vom Robert Koch-Institut aus Mitteln des Bundesgesundheitsministeriums unterstützt wird. Das vom BMBF geförderte Konsortium InfectControl bot den Rahmen für die Arbeiten zu Triazol-Resistenzen und deren Verbreitung in der Umwelt sowie bei klinischen Isolaten. Der von der Deutschen Forschungsgemeinschaft geförderte Exzellenzcluster Balance of the Microverse ermöglichte die Einrichtung der Nachwuchsgruppe Fungal Informatics und unterstützte die bioinformatische Analyse der enormen Datensätze.