Hungrig oder satt: Auf kleinste Details kommt es an
Blick in molekulare Strukturen eines Zellrezeptors
Ein Schalter, der über „hungrig“ oder „satt“ maßgeblich mitbestimmt, ist ein winziges Protein, nur wenige Nanometer groß. Forscher der Charité – Universitätsmedizin Berlin ist es gelungen, das unter anderem für die Regulation des Hungergefühls zuständige Protein, den sogenannten Melanocortin-4-Rezeptor (MC4R), und mit ihm in Interaktion stehende Hormone als räumliche Strukturen im Detail abzubilden. Damit konnte das Forschungsteam die molekularen Mechanismen der Aktivierung, aber auch der Hemmung des Rezeptors im Fachmagazin Cell Research beschreiben.
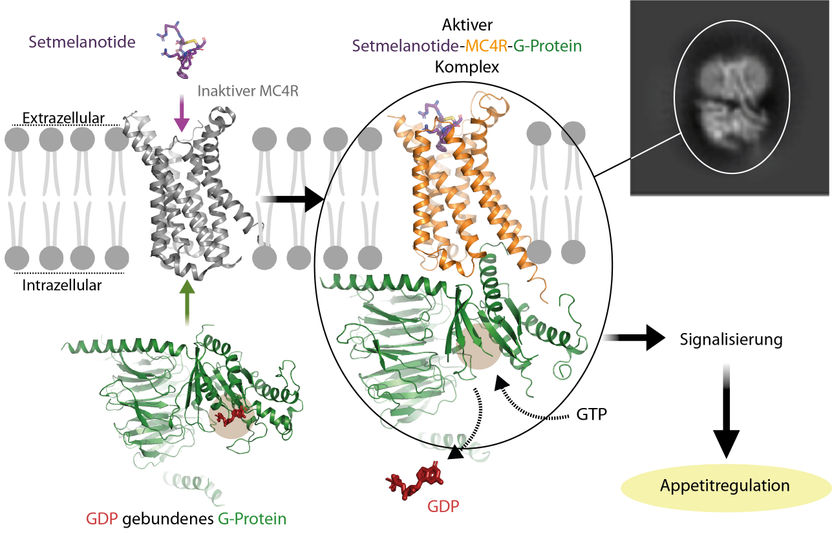
Aktivierung des G-Protein-gekoppelten Rezeptors MC4R – hier durch den Wirkstoff Setmelanotide. Die abgebildete Interaktion des G-Proteins mit dem Rezeptor zeigt, wie das Hormon im Zusammenspiel mit dem Rezeptor das G-protein aktiviert. Der Rezeptor löst im G-Protein die Abspaltung des Nukleotid GDP aus. Dieses wird von dem in der Zelle hoch konzentrierten Nukleotid GTP ersetzt, was wiederum zur Ablösung des G-Proteins vom Rezeptor führt und ein Feuerwerk von Signalen in der Zelle auslöst. Ein aktivierter Rezeptor führt zu sinkendem Appetit, ein blockierter Rezeptor zu einer Steigerung des Hungergefühls.
© Charité l Patrick Scheerer
Die neuen Erkenntnisse können Grundlage für das Design nebenwirkungsarmer Wirkstoffe zur Behandlung stark übergewichtiger oder adipöser Patienten sein. Untersuchungen an den „Schaltern“ der Gewichtsregulation sind aktueller denn je. Es gilt Erkrankungen zu behandeln, bei denen genetische Defekte zu einem Ausbleiben des Sättigungsgefühls und in der Folge einer ausgeprägten, schwer behandelbaren Fettleibigkeit bereits in jungen Jahren führen. Gleichzeitig ist Übergewicht eines der drängenden globalen Probleme. Schätzungsweise 1,6 Milliarden Erwachsene und 650 Millionen Kinder sind momentan weltweit übergewichtig. Damit einher geht ein erhöhtes Risiko für Folgeerkrankungen wie Herz-Kreislauf-Fehlfunktionen oder Diabetes mellitus. Stetig steigende Zahlen und langfristige Konsequenzen treiben Forschende weltweit an, die Mechanismen der Appetitregulation auf molekularer und letztendlich atomarer Ebene zu entschlüsseln. Im Fokus des Interesses stehen die Auswirkungen genetischer Defekte auf Appetit und Hungergefühl wie auch die Suche nach möglichen Stellen, an denen im Krankheitsfall medikamentös eingegriffen werden kann.
In der nun vorliegenden Studie widmet sich das Team um Dr. Patrick Scheerer, Leiter der Arbeitsgruppe Proteinstrukturanalyse und Signaltransduktion am Institut für Medizinische Physik und Biophysik der Charité, einem zentralen Player im Prozess der Regulation des Hungergefühls und damit der Gewichtsregulation des Menschen. Es handelt sich um ein vorwiegend im Gehirn lokalisiertes Protein, das von Hormonen reguliert wird, die durch ein Andocken an das Protein entscheidende Signale für das Sättigungsgefühl auslösen. Solche Proteine werden allgemein Rezeptoren genannt – in diesem Fall ist es der Melanocortin-4-Rezeptor (MC4R). Seine Aktivierung durch stimulierende Hormone (α-/ß-MSH) hemmt das Hungergefühl. Gegenregulator ist das sogenannte Agouti-related peptide (AgRP), es blockiert den Rezeptor und führt zu einem vermehrten Hungergefühl. Genetisch bedingte Fehlfunktionen an diesem „Schalter“-Protein führen bei Menschen sehr häufig zu leichtem oder schwerem Übergewicht. Prof. Dr. Peter Kühnen, Mediziner und Wissenschaftler am Institut für Experimentelle Pädiatrische Endokrinologie, ist auf die Behandlung von Patientinnen und Patienten spezialisiert, bei denen aufgrund von Gendefekten das Sättigungsgefühl unzureichend übermittelt wird. Auf der Suche nach Behandlungsmöglichkeiten für diese Formen der Adipositas hat sich der Endokrinologe intensiv mit den Signalketten der menschlichen Gewichtsregulation befasst, Mutationen in für Botenstoffe und Rezeptoren zuständigen Genen untersucht und mögliche Wirkstoffe analysiert, die einzelne Botenstoffe ersetzen können.
Die Hürde bei einer medikamentösen Behandlung von pathologischem erhöhten Appetit: „Bisher sind diese pharmakologischen Interventionen von Nebenwirkungen begleitet. Diese reichen von einer Dunkelfärbung der Haut – das Melanocortin-Hormon ist unter anderem auch für die Pigmentierung von Haut und Haaren zuständig – bis hin zu kardiovaskulären Ereignissen“, sagt Prof. Kühnen, der auch an der aktuellen Untersuchung mitgewirkt hat und für seine Forschungsleistungen zur Entwicklung neuer, nebenwirkungsärmerer Medikamente mit dem Paul-Martini-Preis ausgezeichnet worden ist. „Die Ursache dieser unerwünschten Wirkungen liegt im Aufbau der vorhandenen Medikamente“, erklärt Studienleiter Dr. Scheerer. „Diese adressieren in der Regel nicht nur ein Ziel, sondern verschiedene Rezeptoren aus der gleichen Familie, die aber eine andere Rolle im Organismus spielen. Je genauer wir die Interaktionen zwischen den beteiligten Komponenten kennen, umso gezielter lässt sich eingreifen.“ Im Sinne der Translation, dem Übertragen wissenschaftlicher Erkenntnisse in die medizinische Praxis, arbeiten die Gruppen um Dr. Scheerer und Prof. Kühnen an der Charité eng zusammen, auch ergänzen sie sich im Rahmen des übergeordneten DFG-Sonderforschungsbereichs (SFB) 1423 „Structural Dynamics of GPCR Activation and Signaling“ der Universität Leipzig, an dem die Charité mit vier Teilprojekten beteiligt ist.
Im Zuge der aktuellen Arbeiten ist es gelungen, die räumliche Struktur des Hormon-Rezeptors MC4R, einem G-Protein-gekoppelten Rezeptor (GPCR), aufzuklären und sichtbar zu machen. Hierfür reichen herkömmliche optische Methoden nicht aus, denn das Protein ist in Nano-Größenordnungen angesiedelt, also winzig klein. „Wir konnten mittels Kryo-Elektronenmikroskopie, einem hochmodernen Verfahren der Bildgebung, die dreidimensionale Struktur des Rezeptors – im Bereich von 0,26 Nanometer – auflösen und darstellen“, sagt Nicolas Heyder, Wissenschaftler am Institut für Medizinische Physik und Biophysik und Erstautor der Studie. „Dabei haben wir den aktiven Rezeptor in zwei Komplexen mit einem Haupteffektor, dem G-protein, der im Inneren der Zelle an den Rezeptor gebunden ist, abgebildet. Die beiden Komplexe unterscheiden sich durch zwei gebundene Hormonvarianten: Setmelanotide und NDP-α-MSH, zwei Wirkstoffe, die in den letzten beiden Jahren als Medikamente zugelassen wurden und die jeweils von einem winzigen Calcium-Ion stabilisiert werden.“ Es hat sich gezeigt, dass beide Rezeptorstrukturen Unterschiede in sehr kleinen, aber wichtigen Punkten hinsichtlich der Bindung der Wirkstoffe und des G-Proteins aufweisen. „Diese molekularen Details geben wichtige Hinweise darauf, warum und wie genau verschiedene Liganden, also Informationsmoleküle, die unterschiedlichen Signalwege des MC4R spezifischer beeinflussen. Für eine pharmakologische Intervention ist das von großer Bedeutung“, erklärt Nicolas Heyder.
Voraussetzung für eine solche Basisarbeit zu kleinsten Zellbestandteilen war neben dem Einsatz der Kryo-Elektronenmikroskopie ein langjähriges Etablieren der Proteinherstellung und -expression in Zellkulturen. Beides wurde an der Charité in Kooperation mit weltweit führenden Laboren und Experten stetig optimiert, unter ihnen Chemie-Nobelpreisträger Brian Kobilka, Professor an der Stanford University School of Medicine und Einstein Visiting Fellow am Berlin Institute of Health (BIH) in der Charité. Im Ergebnis beschreibt die Studie präzise bislang unbekannte Details in der Funktionsweise des Melanocortin-4-Rezeptors – wie er aktiviert, oder aber blockiert wird und wie ein Hormon jeweils mit dem Rezeptor-Protein interagiert und dadurch ein Signal innerhalb der Zelle auslöst. „Wir erkennen jetzt kleinste Unterschiede im Zusammenspiel von Rezeptor-Hormonvarianten, die wichtig sein können, um neue Medikamente, deren Einsatz mit Nebenwirkungen einherging, weiter zu verbessern“, sagt Dr. Scheerer. „Die genaue Struktur der Hormonbindungstasche ist nun bekannt und kann gezielt adressiert werden.“ Das ist ein Schlüssel im translationalen Verständnis zwischen endokrinologischen Aspekten, hier der Hormonregulation, und den strukturellen Eigenschaften zusammenspielender Proteine.
Insbesondere konnte das Forschungsteam aufzeigen, wie sich ein bereits vor der Untersuchung bekannter, den Rezeptor inaktivierender Regulator – ein Antagonist – in seiner Bindung im Wesentlichen an nur einer Stelle vom aktivierenden Agonisten unterscheidet, sonst aber fast identisch gebunden ist. „Dieser Unterschied deutet sehr genau darauf hin, an welcher Stelle der Rezeptor blockiert werden kann und wo eine sensible Schalterstelle für die Aktivierung des Proteins lokalisiert ist“, so Dr. Scheerer. In künftigen Arbeiten wollen die Forscher noch mehr über das System mit MC4R im Zentrum herausfinden und damit Ansatzpunkte für eine gezielte Beeinflussung. So gilt es nun zu verstehen, wie der Rezeptor auf molekularer Ebene durch zusätzliche Einflüsse gesteuert wird. Einige direkt interagierende Faktoren sind bereits bekannt, nicht bekannt dagegen ist, wie sie auf das Zusammenspiel einwirken.
























































