Darmbakterien beeinflussen Gehirnentwicklung
Forscher entdecken Biomarker, die frühzeitig auf Hirnverletzungen bei extremen Frühchen hinweisen
Extrem Frühgeborene haben ein hohes Risiko für Hirnschäden. Forscher der Universität Wien und der Medizinischen Universität Wien haben nun Ansatzpunkte für die frühzeitige Behandlung solcher Schäden außerhalb des Gehirns gefunden: Bakterien im Darm der Frühgeborenen spielen dabei eine Schlüsselrolle. Das Forschungsteam fand heraus, dass die Überwucherung des Magen-Darm-Trakts mit Klebsiella-Bakterien mit einem erhöhten Vorkommen bestimmter Immunzellen und der Entwicklung neurologischer Schäden bei frühgeborenen Babys verbunden ist. Die Studie erscheint nun in der Fachzeitschrift Cell Host & Microbe.
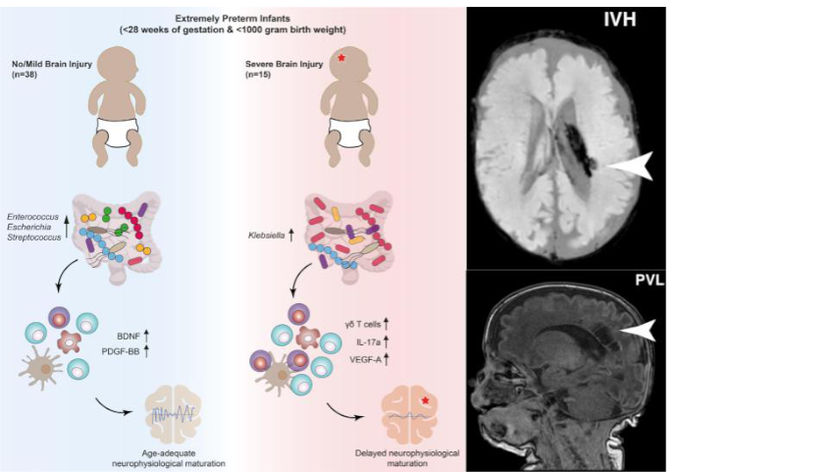
Seki et al. haben ein umfassendes Profil der Entwicklung von Mikrobiota, des Immunsystems, sowie der Neurophysiologie bei Frühgeborenen erstellt. Ihre Forschung verknüpfte die Etablierung des Mikrobioms im frühen Leben mit immunologischer und neurologischer Entwicklung, und identifizierte potenzielle Biomarker für perinatale Hirnverletzungen. Zusammenfassend (links) zeigten ihre Ergebnisse, dass eine proinflammatorische T-Zellen-Reaktion mit einer unterdrückten elektrokortikalen Reifung korreliert. γδ T-Zellen nahmen dabei eine zentrale Rolle für die weitere Entstehung schwerer Hirnschäden ein. Darüber hinaus war die Überwucherung von Klebsiella Bakterien im Magen-Darm-Trakt in hohem Maße prädiktiv für Hirnschäden. Rechts sind Manifestationen solcher Hirnverletzungen zu sehen. Die repräsentative Abbildungen zeigen eine intraventrikuläre Hirnblutung (IVH; rechts oben), sowie eine periventrikulären Leukomalazie (PVL; rechts unten), und wurden via bildgebender Schädel-Kernspintomographie aufgenommen.
© Seki et al., 2021
Komplexes Zusammenspiel: Die Darm-Immunsystem-Gehirn-Achse
Die frühkindliche Entwicklung des Darms, des Gehirns und des Immunsystems hängen eng zusammen. Die Forschung spricht von einer Darm-Immunsystem-Gehirn-Achse. Dabei kooperieren Bakterien im Darm mit dem Immunsystem, welches die Darmmikroben im Blick behält und passende Reaktionen darauf entwickelt. Mit dem Gehirn steht der Darm wiederum über den Vagusnerv, aber auch vermittelt über das Immunsystem, in Kontakt. "Wir haben untersucht, welche Rolle diese Achse für die Gehirnentwicklung extremer Frühchen spielt", sagt der Erstautor der Studie David Seki. "Die Mikroorganismen des Darmmikrobioms – das ist eine lebenswichtige Ansammlung hunderter Arten von Bakterien, Pilzen, Viren und anderen Mikroben im Darm – befinden sich bei gesunden Menschen in einem Gleichgewicht. Gerade bei Frühgeborenen, deren Immunsystem und Mikrobiom sich nicht vollständig ausbilden konnten, sind hier aber Verschiebungen wahrscheinlich, die dann auch negative Auswirkungen auf das Gehirn haben können", erzählt der Mikrobiologe und Immunologe.
Muster im Mikrobiom geben Hinweise auf Hirnschädigungen
"Tatsächlich konnten wir bestimmte Muster im Mikrobiom und in der Immunantwort identifizieren, die eindeutig mit dem Fortschreiten und der Schwere von Hirnverletzungen zusammenhängen", ergänzt David Berry, Mikrobiologe und Leiter der Forschungsgruppe am Zentrum für Mikrobiologie und Umweltsystemwissenschaft der Universität Wien, sowie Leiter der Joint Microbiome Facility – einem wissenschaftlichen Verbund zwischen Universität Wien und Medizinischer Universität Wien. "Entscheidend ist nun, dass sich solche Muster oft noch vor den Veränderungen im Gehirn zeigen. Damit öffnet sich ein kritisches Zeitfenster, in dem man Hirnschäden extremer Frühchen vermeiden oder aber eine Verschlimmerung verhindern kann."
Umfassende Untersuchung der Entwicklung extrem frühgeborener Säuglinge
Ausgangspunkte für die Entwicklung entsprechender Therapien bieten die Biomarker, die das intersiziplinäre Team identifizieren konnte. "Unsere Daten zeigen, dass ein übermäßiges Wachstum des Bakteriums Klebsiella und die damit verbundenen erhöhten γδ-T-Zellwerte Hirnschädigungen offensichtlich verschlimmern können", erläutert Lukas Wisgrill, Neonatologe an der Abteilung für Neonatalogie, Pädiatrische Intensivmedizin und Neuropädiatrie der Universitätsklinik für Kinder- und Jugendheilkunde der Medizinischen Universität Wien. "Diesen Mustern konnten wir auf die Spur kommen, weil wir für eine sehr spezifische Gruppe von Neugeborenen erstmals detailliert erforscht haben, wie sich das Darmmikrobiom, das Immunsystem und das Gehirn entwickeln und wie sie dabei interagieren", fügt er hinzu. Die Studie begleitete insgesamt 60 extrem Frühgeborene, die vor der 28. Schwangerschaftswoche und mit einem Gewicht von weniger als 1 Kilogramm geboren wurden, über mehrere Wochen, teilweise Monate. Mit hochmodernen Verfahren analysierten die Forscher das Mikrobiom, Immunzellen, Hirnstrommessungen (z.B. aEEG) und MRT-Aufnahmen des Gehirns der Säuglinge.
Forschung wird in zwei Studien fortgesetzt
Weitere Erhebungen sollen hier auf gleich zwei Ebenen anknüpfen: Die Studie, die als interuniversitäres Clusterprojekt unter der gemeinsamen Leitung von Angelika Berger (Comprehensive Center for Pediatrics, Medizinische Universität Wien) und David Berry (Universität Wien) umgesetzt wurde, ist Startpunkt für ein Forschungsvorhaben, welches das Mikrobiom und seine Bedeutung für die neurologische Entwicklung frühgeborener Kinder noch eingängiger untersuchen wird. Darüber hinaus möchten die Forscher die Kinder der Ausgangsstudie weiterhin begleiten. "Wie sich die motorischen und kognitiven Fähigkeiten der Kinder entwickeln, zeigt sich letztlich erst über mehrere Jahre hinweg", erklärt Angelika Berger. "Wir möchten noch besser verstehen, wie sich diese sehr frühe Entwicklung der Darm-Immunsystem-Gehirn-Achse langfristig auswirkt." Die wichtigsten Kooperationspartner für das Vorhaben sind bereits an Bord: "Die Eltern der Kinder haben uns mit großem Interesse und großer Offenheit in der Studie unterstützt", erzählt David Seki. "Letztlich konnten wir nur deshalb diese wichtigen Erkenntnisse gewinnen. Dafür sind wir sehr dankbar."
Originalveröffentlichung
David Seki, Margareta Mayer, Bela Hausmann, Petra Pjevac, Vito Giordano, Katharina Goeral, Lukas Unterasinger, Katrin Klebermaß-Schrehof, Kim De Paepe, Tom Van de Wiele, Andreas Spittler, Gregor Kasprian, Benedikt Warth, Angelika Berger, David Berry & Lukas Wisgrill; "Aberrant gut microbiota-immune-brain axis development in premature neonates with brain damage"; Cell Host & Microbe; 2021