Erstes künstliches Gewebemodell entwickelt, in dem Blutgefäße wachsen
Zellen brauchen Bewegungsfreiheit, um ausreichend große Blutgefäße zu bilden
Forscher um die Biomedizin-Ingenieurin Dr. Britta Trappmann vom Max-Planck-Institut für molekulare Biomedizin in Münster haben ein Zellkultursystem entwickelt, in dem sich erstmals in einem Gerüst aus künstlichen Materialien ein funktionsfähiges Blutgefäßsystem bildet. Das Team untersucht, welche Materialeigenschaften einzelne Parameter der Gefäßbildung fördern – ein Schritt auf dem Weg zur Zukunftsvision implantierbarer künstlicher Gewebe. Die Studie ist in der Fachzeitschrift „Nature Communications“ erschienen.
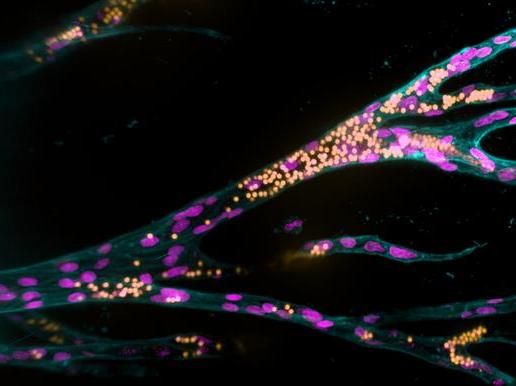
Aus einem Ursprungsblutgefäß (senkrecht links im Bild) bilden Endothelzellen (pinke Zellkerne) in einem künstlichen Hydrogel neue Blutgefäße. Fluoreszierende Kügelchen (gelb) simulieren den Blutfluss.
Jifeng Liu, MPI Münster
Im Labor Gewebe herzustellen, mit denen sich geschädigte Organe heilen oder ersetzen lassen, ist eine der großen Zukunftsvisionen der Medizin. Künstliche Materialien könnten sich als Gewebegerüste eignen, denn anders als natürliches Gewebe bleiben sie im Organismus lange genug stabil, so dass der Körper neue natürliche Strukturen ausbilden kann. Eine grundlegende Voraussetzung für funktionsfähige Gewebe ist, dass in ihnen Blutgefäße wachsen und sich mit dem Gefäßsystem des Organismus verbinden können, so dass das Gewebe durchblutet und mit Sauerstoff und Nährstoffen versorgt wird. Bisher ist allerdings fast nichts darüber bekannt, welche Materialeigenschaften das Wachstum von Blutgefäßen fördern.
Ein Team um die Biomedizin-Ingenieurin Dr. Britta Trappmann vom Max-Planck-Institut für molekulare Biomedizin in Münster hat jetzt ein Zellkultursystem entwickelt, in dem sich zum ersten Mal in einem Gerüst aus künstlichen Materialien ein funktionsfähiges Blutgefäßsystem bildet. Die Wissenschaftlerinnen und Wissenschaftler arbeiteten mit einem speziellen Hydrogel, dessen Eigenschaften sie kontrolliert verändern können, und ließen darin ein Ursprungsblutgefäß aus menschlichen Blutgefäßzellen wachsen. Sie untersuchten, wie die Materialeigenschaften der künstlichen Zellumgebung die Bildung weiterer Blutgefäße beeinflussten, und stimmten diese fein aufeinander ab. Ihre wichtigsten Erkenntnisse: „Das künstliche Gewebematerial muss bestimmte Adhäsionsmoleküle in der Membran von Blutgefäßzellen aktivieren, damit die Zellen in Gruppen aus dem Ursprungsgefäß auswandern und röhrenförmige Strukturen bilden – gleichzeitig muss das Material für die Blutgefäßzellen schnell genug abbaubar sein, damit sie Gefäße in ausreichender Größe formen können“, erklärt Britta Trappmann. Um sich an die natürliche Umgebung von Zellen anzunähern, müssten in weiteren Schritten zahlreiche weitere Biomoleküle und Zellen in das Modellsystem integriert werden, beispielsweise Signalproteine, Immunzellen oder die Blutgefäße stabilisierende Zellen. „Die Wirkung all dieser Faktoren ist in natürlichem Gewebe zudem gekoppelt und von Organ zu Organ unterschiedlich“, ergänzt die Wissenschaftlerin. All das zu verstehen, sei ein Fernziel. Das Wissen könnte man dann nutzen, um implantierbare Gewebe zu entwickeln.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Zellkulturtechnik
Die Zellkulturtechnik ist ein zentraler Pfeiler in der biotechnologischen und pharmazeutischen Forschung und Entwicklung. Sie ermöglicht das Wachstum und die Pflege von Zellen unter kontrollierten Laborbedingungen und bietet so ein Fenster in die molekularen und zellulären Prozesse des Lebens.

Themenwelt Zellkulturtechnik
Die Zellkulturtechnik ist ein zentraler Pfeiler in der biotechnologischen und pharmazeutischen Forschung und Entwicklung. Sie ermöglicht das Wachstum und die Pflege von Zellen unter kontrollierten Laborbedingungen und bietet so ein Fenster in die molekularen und zellulären Prozesse des Lebens.























































