Zellkontrolle der Mitochondrien entschlüsselt
Forscher entdecken ein Signalprotein, das den Aufbau der Zellkraftwerke des Menschen steuert
Fehler in den Stoffwechselvorgängen der Mitochondrien sind verantwortlich für eine Vielzahl von Erkrankungen wie etwa Morbus Parkinson oder Alzheimer. Der Import der Bauelemente für den komplexen biochemischen Apparat in diesen Zellbereichen spielt dabei eine große Rolle. Der sogenannte TOM-Komplex (translocase of the outer mitochondrial membrane) gilt als Tor zum Mitochondrium, dem sprichwörtlichen Kraftwerk der Zelle. Die Arbeitsgruppe von Prof. Dr. Chris Meisinger am Institut für Biochemie und Molekularbiologie der Universität Freiburg konnte nun in menschlichen Zellen zeigen, wie Signalmoleküle dieses Tor steuern: Ein Signalprotein namens DYRK1A modifiziert die molekulare Maschinerie von TOM und macht es durchlässiger für Enzymen, die für den Stoffwechsel wichtig sind. Die Gruppe entdeckte somit das erste Signalprotein, welches im Menschen direkten Einfluss auf diesen Importvorgang nimmt. Die Arbeit erschien in der Fachzeitschrift Nature Communications.
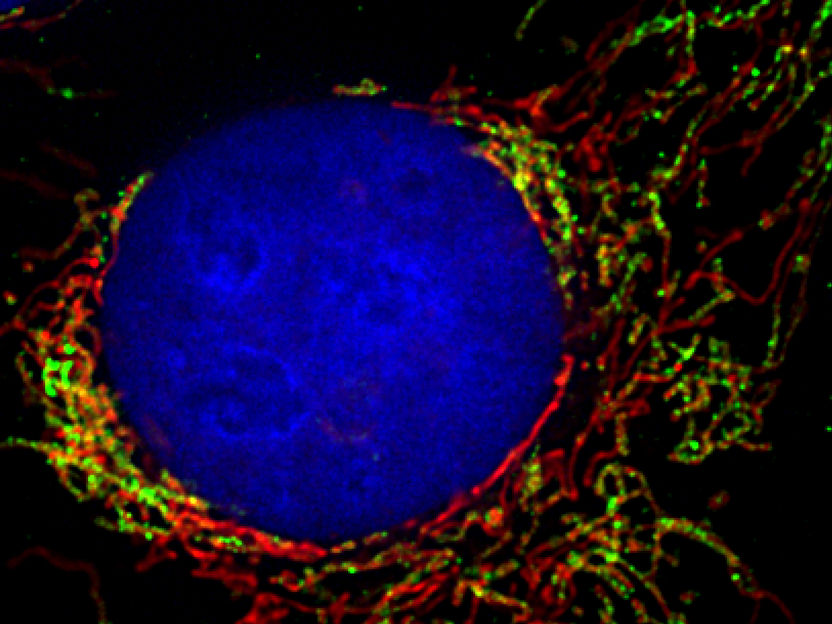
Das Netzwerk der Mitochondrien zieht sich schnurartig durch die gesamte menschliche Zelle (in grün und rot mit Fluoreszenzproteinen markiert). Der Zellkern ist blau angefärbt.
Pablo Sánchez-Martín/Universität Freiburg
Entwicklungsstörungen im neuen Licht
DYRK1A ist bei neurologischen Entwicklungsstörungen wie Autismus, Mikrozepahlie und Down-Syndrom defekt: „Der Zusammenhang mit den Mitochondrien ist neu. Diese Ergebnisse ermöglichen uns diese Erkrankungen besser zu verstehen und Behandlungsstrategien zu entwickeln“, erklärt Dr. Adinarayana Marada aus Meisingers Team.
„Lange Zeit dachten Forschende, dass der TOM-Komplex ein starres Gebilde in der Mitochondrienmembran ist, dessen Türen immer offenstehen“, erklärt Meisinger. Sein Team wies vor kurzem in Bäckerhefen Signalmechanismen nach, die je nach Stoffwechselzustand der Zelle oder bei plötzlichem Stress die Untereinheiten des TOM-Komplexes verändern. Die Zelle kann so den Einstrom der Vorstufenproteine für Bauelemente des Stoffwechsels gezielt steuern und die Funktion der Mitochondrien an ein verändertes Zellgeschehen anpassen. Ob solche Mechanismen auch beim Menschen existieren, war bislang unbekannt.
DYRK1A wirkt am TOM-Komplex
Die Erstautoren der Studie Dr. Corvin Walter und Dr. Adinarayana Marada aus Meisingers Arbeitsgruppe entwickelten einen systematischen Ansatz, um solchen Signalmechanismen, wie sie etwa so genannte Proteinkinasen auslösen, beim Menschen auf die Spur zu kommen. Sie prüften über mehrere Jahre Kandidaten mit zellbiologischen und bioinformatischen Methoden und wurden fündig: DYRK1A, eine solche Proteinkinase, wirkt am TOM-Komplex. „Damit haben wir tatsächlich die Stecknadel im Heuhaufen gefunden“, sagt Walter.
Originalveröffentlichung
Walter, C., Marada, A., Suhm, T., Ernsberger, R., Muders, V., Kücükköse, C., Sánchez-Martín, P.,Hu,Z.,Aich, A., Loroch, S., Solari, F.A., Poveda-Huertes, D., Schwierzok, A., Pommerening, H., Matic, S., Brix, J., Sickmann, A., Kraft, C., Dengjel, J., Dennerlein, S., Brummer, T., Vögtle, F.N., and Meisinger, C.; "Global kinome profiling reveals DYRK1A as critical activator of the human mitochondrial import machinery"; Nat. Commun.; 2021; 12:4284.
Meistgelesene News
Originalveröffentlichung
Walter, C., Marada, A., Suhm, T., Ernsberger, R., Muders, V., Kücükköse, C., Sánchez-Martín, P.,Hu,Z.,Aich, A., Loroch, S., Solari, F.A., Poveda-Huertes, D., Schwierzok, A., Pommerening, H., Matic, S., Brix, J., Sickmann, A., Kraft, C., Dengjel, J., Dennerlein, S., Brummer, T., Vögtle, F.N., and Meisinger, C.; "Global kinome profiling reveals DYRK1A as critical activator of the human mitochondrial import machinery"; Nat. Commun.; 2021; 12:4284.
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.




















































