Pflanzenschutzmittel von innen
Wie Pflanzen ihre lichtsammelnden Membranen gegen Umweltstress stärken
Eine internationale Studie unter Leitung des Helmholtz Zentrums München hat die Struktur eines Proteins aufgeklärt, das photosynthetische Membranen aufbaut und aufrechterhält. Diese Erkenntnisse legen den Grundstein für biotechnologische Anstrengungen um Pflanzen gegen Umweltstress zu stärken und so die menschliche Nahrungsversorgung zu sichern und den Klimawandel zu bekämpfen.
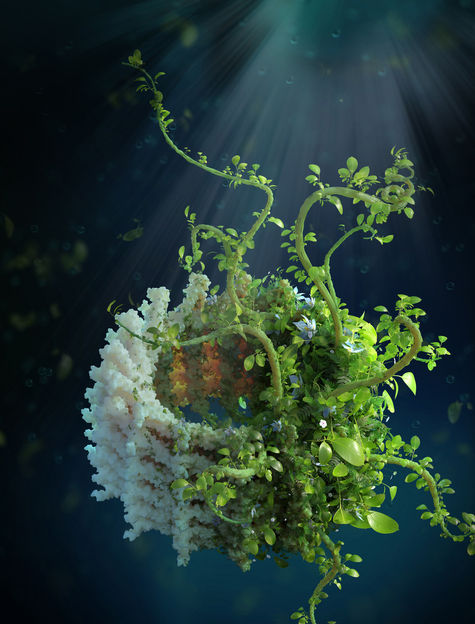
Künstlerische Darstellung der VIPP1-Ringstruktur, mit üppigem Pflanzenleben bedeckt. Sie stellt die zentrale Rolle von VIPP1 beim Aufbau und der Aufrechterhaltung der photosynthetischen Thylakoidmembranen dar, die den Pflanzen das Wachstum ermöglichen. Die Studie ist auf dem Cell Cover abgebildet (8. Juli).
Verena Resch. © Helmholtz Zentrum München / Ben Engel
Pflanzen, Algen und Cyanobakterien betreiben Photosynthese und nutzen die Energie des Sonnenlichts, um Sauerstoff und biochemische Energie zu produzieren, die den Großteil des Lebens auf der Erde antreiben. Außerdem nehmen sie Kohlendioxid (CO2) aus der Atmosphäre auf und wirken so der Anreicherung dieses Treibhausgases entgegen. Durch den Klimawandel sind photosynthetische Organismen jedoch einem zunehmenden Umweltstress ausgesetzt, der ihr Wachstum hemmt und langfristig die Ernährung der Menschheit gefährdet.
Die wichtigen ersten Schritte der Photosynthese finden innerhalb der Thylakoidmembranen statt. Diese enthalten Proteinkomplexe, die das Sonnenlicht einfangen. Seit Jahrzehnten ist bekannt, dass das Protein VIPP1 (vesicle-inducing protein in plastids) bei fast allen photosynthetischen Organismen – von Pflanzen an Land bis zu Algen und Cyanobakterien im Meer – entscheidend ist für die Bildung der Thylakoidmembranen. Bisher war es jedoch ein Rätsel, wie VIPP1 diese essentielle Funktion ausführt. In der aktuellen Ausgabe der Zeitschrift Cell hat eine neue Studie einer internationalen Forschungsgruppe unter der Leitung von Ben Engel am Helmholtz Pioneer Campus des Helmholtz Zentrums München die Struktur und den Mechanismus von VIPP1 auf molekularer Ebene enthüllt.
Aufbau und Schutz photosynthetischer Membranen
Mit Hilfe von Kryo-Elektronenmikroskopie erstellten die Forschenden eine erste hochaufgelöste Struktur von VIPP1. Die Kombination dieser Strukturanalyse mit weiteren funktionellen Untersuchungen zeigte, wie sich VIPP1 zu einer verwobenen Membranhülle zusammensetzt, welche die Thylakoidmembranen formt. Die Forschungsgruppe nutzte auch den hochmodernen Ansatz der Kryo-Elektronentomographie, um VIPP1-Membranen in der nativen Umgebung von Algenzellen abzubilden. Indem sie spezifische Mutationen an VIPP1 vornahmen, beobachteten die Forschenden, dass die Interaktion von VIPP1 mit Thylakoidmembranen entscheidend ist, um die strukturelle Integrität dieser Membranen unter hohem Lichtstress aufrechtzuerhalten. „Unsere Studie zeigt, dass VIPP1 eine zentrale Rolle sowohl bei der Entstehung der Thylakoide als auch bei ihrer Anpassung an Umweltveränderungen spielt“, erklärt Erstautor Tilak Kumar Gupta vom Max-Planck-Institut für Biochemie.
Diese Studie legt den Grundstein für ein besseres mechanistisches Verständnis darüber, wie sich Thylakoide bilden und aufrechterhalten. Sie bietet auch neue Möglichkeiten für die Stärkung von Pflanzen, die widerstandsfähiger gegen extreme Umweltbedingungen sind. „Die Erkenntnisse über die molekularen Mechanismen, die den Thylakoid-Umbau steuern, sind ein wichtiger Schritt auf dem Weg zur Entwicklung von Nutzpflanzen, die nicht nur schneller wachsen, einen höheren Ertrag und eine höhere Resistenz gegen Umweltstress aufweisen, sondern auch mehr atmosphärisches CO2 binden, um dem Klimawandel entgegenzuwirken“, erklärt Ben Engel.
Gemeinsame internationale Forschung
Diese interdisziplinäre Studie brachte Köpfe verschiedener Forschungseinrichtungen zusammen: der Technischen Universität Kaiserslautern (Michael Schroda), der Philipps-Universität Marburg (Jan Schuller), der Ludwig-Maximilians-Universität München (Jörg Nickelsen), der Okayama University in Japan (Wataru Sakamoto), der McGill University in Kanada (Mike Strauss), der Ruhr-Universität Bochum (Till Rudack), des Max-Planck-Instituts für Biochemie (Wolfgang Baumeister und Jürgen Plitzko) und des Helmholtz Zentrums München. „Unsere Studie erschließt viele neue Wege und nutzt eine Vielzahl von Techniken. Das war nur dank der enormen gemeinsamen Anstrengungen der Forschenden in unserem internationalen Konsortium möglich“, sagt Ben Engel.