Das Start-Stopp-System jagender Immunzellen
Immunzellen koordinieren Schwarmverhalten, um gemeinsam Krankheitserreger zu eliminieren
Neutrophile Granulozyten sind Fresszellen der angeborenen Immunantwort und gehören zu den Ersthelfern unseres Immunsystems. Sie patrouillieren durch unsere Blutgefäße und wandern bei ersten Anzeichen einer Entzündung oder Infektion schlagartig ins Gewebe ein, um dort Krankheitserreger zu finden, aufzunehmen und durch Verdau zu eliminieren. Zur effektiven Bekämpfung der Erreger in einem entzündeten Gewebe arbeiten die Zellen im Kollektiv. Sie schließen sich zu Zellschwärmen zusammen und greifen gemeinsam an. Forschende am Max-Planck-Institut für Immunbiologie und Epigenetik in Freiburg entschlüsseln die grundlegende Biologie dieser Neutrophilenschwärme und konnten nun zeigen, dass die Zellen auch ein molekulares Programm entwickelt haben, um ihre Schwarmaktivität selbstständig zu stoppen. Die Studie klärt auf, wie schwärmende Neutrophile unempfindlich gegenüber den eigenen Signalstoffen werden, mit denen sie den Schwarm ursprünglich ins Leben riefen. Dieses Stopp-Signal ist entscheidend für die effektive Beseitigung von Bakterien in Geweben.
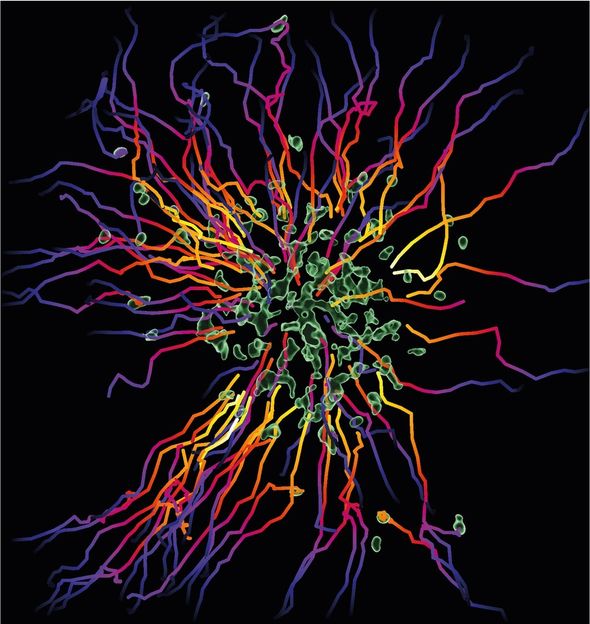
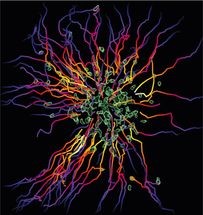
Neutrophile (grün) bilden Zellschwärme und sammeln sich an Gewebestellen, wo sie beschädigte Zellen oder eindringende Mikroben eindämmen müssen. Die mehrfarbigen Bahnen zeigen die Bewegungspfade der Neutrophilen an.
© MPI of Immunobiology & Epigenetics/ T. Lämmermann
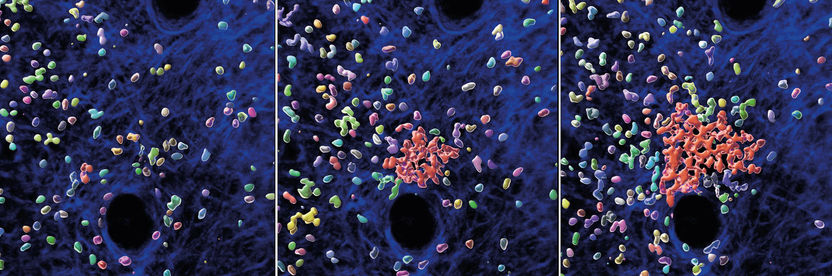
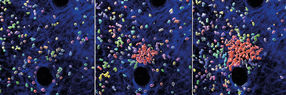
Blick in lebendes Gewebe der Maus. Einzelne Neutrophile ziehen weitere Zellen an, um die Bildung eines Neutrophilenschwarms und -clusters zu initiieren. Die Abbildungen zeigen verschiedene Zeitpunkte einer 30-minütigen Zeitsequenz. Neutrophile (mehrfarbig), Neutrophilen-Cluster (rot) und strukturelle Komponenten der Mäusehaut (blau) sind mit verschiedenen Farben dargestellt.
© MPI of Immunobiology & Epigenetics/ T. Lämmermann
Der Körper ist durch Barrieren wie die Haut gut vor eindringenden Krankheitserregern geschützt. Bei Verletzungen wie etwa einem Riss in der Haut können jedoch Krankheitserreger leicht durch die Wunde in den Körper eindringen und schwere Infektionen verursachen. Wenn dies geschieht, übernimmt das angeborene Immunsystem die erste Verteidigungslinie mit einem effektiven Arsenal an zellulären Waffen. Als einer der ersten Zelltypen vor Ort werden neutrophile Granulozyten, auch kurz Neutrophile genannt, innerhalb weniger Stunden aus dem Blutkreislauf in das verletzte Gewebe rekrutiert, um möglichst schnell potenzielle mikrobielle Eindringlinge zu zerstören.
Schwärme bekämpfen die Infektion
„Neutrophile sind besonders effektiv beim Jagen und Töten von Bakterien“, sagt Tim Lämmermann. Der Forschungsgruppenleiter am Max-Planck-Institut für Immunbiologie und Epigenetik in Freiburg erforscht diesen wichtigen Zelltyp. Neutrophile machen etwa 50 bis 70 Prozent der weißen Blutkörperchen im menschlichen Körper aus. Man schätzt, dass bei einem Erwachsenen jeden Tag etwa 100 Milliarden Neutrophile aus Stammzellen im Knochenmark gebildet werden.
„Diese Zellen patrouillieren in fast alle Ecken unseres Körpers, und sie sind echte Spezialisten darin, alles potenziell Schädliche aufzuspüren. Sobald einzelne Neutrophile geschädigte Zellen oder eindringende Keime im Gewebe entdecken, rufen sie mittels chemischer Signale weitere Zellen zur Hilfe. Dies geschieht über Botenstoffe, die von Rezeptoren an der Zelloberfläche der Neutrophile erkannt werden.“ Durch diese interzelluläre Kommunikation können Neutrophile gemeinsam als Zellkollektiv agieren und im Schwarm die Beseitigung von Krankheitserregern effektiv koordinieren.
Schmaler Grat zwischen Schutz vor Erregern und Zerstörung von Gewebe
Diese nützliche Entzündungsreaktion kann aber auch überschießen und zu massiven Gewebeschäden führen. Wenn die Intensität oder die Dauer der Immunantwort fehlreguliert ist, können dieselben Mechanismen, welche eindringende Krankheitserreger zerstören, auch Kollateralschäden an gesundem Gewebe verursachen. Die von den Neutrophilen freigesetzten Substanzen zur Abtötung der Krankheitserreger können so auch schädlich für die umliegende Gewebestruktur aus Eiweißen und Zuckern sein. „In dieser Studie haben wir deshalb mit der Frage begonnen, auf welche Weise das Schwarmverhalten zum Erliegen kommt, um eine unkontrollierte Anhäufung von Neutrophilen zu vermeiden und so eine übermäßige Entzündung zu verhindern. Fehlregulierte Immunreaktionen können zur Entstehung von degenerativen Krankheiten wie Krebs, Diabetes und Autoimmunerkrankungen beitragen“, sagt Tim Lämmermann. In früheren Studien haben er und sein Team bereits die molekularen Mechanismen entdeckt, die das kollektive Schwarmverhalten ursprünglich auslösen. Unbekannt blieben jedoch die Prozesse, die diese Reaktion wieder beenden.
Die Erforschung des Schwarmverhalten von Neutrophilen ist noch ein relativ junges Thema in der Entzündungs- und Infektionsforschung. Die neueste Studie aus dem Labor von Tim Lämmermann konnte nun aufklären, wie Neutrophile ihre Schwarmaktivität in bakteriell infiziertem Gewebe selbst begrenzen und somit eine optimale Balance zwischen Such- und Zerstörungsphasen von Pathogenen bei deren Beseitigung ermöglichen.
Durch den Einsatz spezieller Mikroskope zur Echtzeit-Visualisierung der Immunzelldynamik in lebendem Mausgewebe zeigen die Forschenden, dass schwärmende Neutrophile über die Zeit unempfindlich gegenüber ihren eigenen Signalen werden, mit denen sie den Schwarm ursprünglich initiiert haben. „Wir haben sozusagen die molekulare Bremse gefunden, mit der die Neutrophilen ihre Bewegung stoppen, sobald sie hohe Konzentrationen der sich anhäufenden Schwarmlockstoffe in Neutrophilen-Clustern wahrnehmen“, erläutert Tim Lämmermann. „Das war überraschend, denn die vorherrschende Meinung war eigentlich, dass externe Signale aus der Gewebeumgebung entscheidend sind, um die Neutrophilenaktivität in der Auflösungsphase einer Entzündung zu dämpfen“, sagt Wolfgang Kastenmüller, von der Max-Planck-Forschungsgruppe Systemimmunologie an der Universität Würzburg.
Internes Start-Stopp-System für optimale Keimbeseitigung
Angesichts des entdeckten Start-Stopp-Systems in Neutrophilen überprüften die Forschenden auch die gängigen Ansichten zu Bewegungsmustern und Jagdstrategien von Neutrophile. In Experimenten mit Neutrophilen, denen der Start-Stopp-Mechanismus fehlte, beobachtete das Team, dass diese Zellen viel schneller im Gewebe waren und somit sehr große Gewebebereiche nach Bakterien absuchen konnten. Dieses verstärkte Schwarmverhalten machte diese Zellen jedoch nicht zu besseren Killern. „Überraschenderweise war das Gegenteil der Fall. Neutrophile haben keinen Vorteil davon, sich besonders schnell im Gewebe zu bewegen und ohne Bremse wie verrückt umherzueilen. Stattdessen scheint es wesentlich vorteilhafter zu sein, wenn sie zusammenkommen, stehen bleiben und dann in der Gruppe eine schöne Bakterienmahlzeit genießen – auf diese Weise wird das bakterielle Wachstum viel besser im Gewebe eingedämmt“, erklärt Tim Lämmermann.
Die Ergebnisse der Forscher tragen zu einem besseren Verständnis der Biologie der Neutrophilen bei, welche für die Immunabwehr gegen Bakterien von besonderer Bedeutung sind. Die Forscher hoffen, dass ihre unerwarteten Erkenntnisse zu den Jagdstrategien der Immunzellen wichtige Impulse vor allem für neue therapeutische Ansätze liefern können. Darüber hinaus könnten die beschriebenen Mechanismen zu Schwarmverhalten auch die Forschung anderer Kategorien von kollektivem Verhalten und Selbstorganisation bei Zellverbänden oder etwa Insekten bereichern.