Eine Haarnadel gegen Krebs
Bizyklische Protein-Mimetika inhibieren das Onkogen β-Catenin
Die Hemmung krankmachender Protein-Protein-Wechselwirkungen ist ein vielversprechender therapeutischer Ansatz für eine Vielzahl von Krankheiten, einschließlich vieler Formen von Krebs. Ein Forschungsteam hat jetzt ein bizyklisches Peptid entwickelt, das β-Catenin bindet, ein Protein, das mit bestimmten Tumorarten in Verbindung steht. Erfolgsgeheimnis sind die zyklische Struktur und die Haarnadelform des Peptids, die eine natürliche Proteinstruktur nachahmt, wie das Team in der Zeitschrift Angewandte Chemie berichtet.
© Wiley-VCH
Aufgrund der an Protein-Protein-Wechselwirkungen beteiligten ausgedehnten Protein-Bereiche sind therapeutische Ansätze mit kleinen Molekülen oft nicht erfolgreich. Eine Alternative stellen Protein-Mimetika dar, die die räumliche Struktur bindender Abschnitte der natürlichen Bindungspartner nachahmen. Proteinstrukturen aus mehreren nebeneinander angeordneten lang gestreckten Peptidketten, die an ein ziehharmonikaartig gefaltetes Blatt Papier erinnern (β-Faltblätter) spielen oft eine Rolle bei der Interaktion von Proteinen, wurden aber bisher nur selten als Ansatzpunkt für Mimetika herangezogen. Dies liegt unter anderem daran, dass sie nicht leicht in die Zielzellen gelangen und daher das pathogene Protein nicht erreichen können.
Das von Tom N. Grossmann geleitete internationale Team von der Freien Universität Amsterdam, der Universität Neapel Federico II sowie AstraZeneca (Cambridge, UK) berichtet jetzt vom Design von β-Faltblatt-Mimetika, die das intrazelluläre tumorerzeugende Protein β-Catenin hemmen. β-Catenin ist Bestandteil der Wnt-Signalkaskade und aktiviert T-Zell-Faktoren (TCF), die letztlich Zellwachstum und Proliferation stimulieren. Eine Hyperaktivierung des Wnt-Wegs steht in Verbindung mit verschiedenen Formen von Krebs. Die Hemmung der Wechselwirkung zwischen β-Catenin und TCF stellt somit einen attraktiven therapeutischen Ansatz dar.
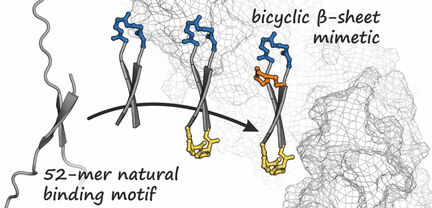
Basierend auf der bekannten Struktur von β-Catenin im Komplex mit einem Protein stellte das Team zunächst einen Bindungspartner für β-Catenin her: ein zu einem Ring geschlossenes Peptid, das ein kurzes antiparalleles β-Faltblatt – eine sogenannte β-Haarnadelstruktur – ausbildet, wenn es an β-Catenin gebunden vorliegt, wie eine Analyse der Kristallstruktur ergab. Die Idee war nun, dieses zyklische Peptid durch Einführung einer zusätzlichen Verbrückung in einer Haarnadel-Form zu fixieren. Dies erzeugt eine bizyklische Struktur, die die Bindung an β-Catenin verstärkt. Aus einer Reihe synthetisierter Varianten konnte das Team mehrere Bizyklen mit hoher Affinität zu β-Catenin identifizieren. Unter diesen Treffern fand sich ein Bizyklus, der (anders als das ursprüngliche zyklische Peptid) sehr gut von Zellen aufgenommen wird und die onkogene Wnt-Signalkaskade deutlich inhibiert.
Das neu entwickelte bizyklische β-Faltblatt-Mimetikum stellt damit einen möglichen Ausgangspunkt für die Entwicklung neuer Antitumor-Wirkstoffe dar, die die zelluläre Wnt-Signalkaskade hemmen. Die Strategie könnte zudem das Design weiterer Inhibitoren anderer durch β-Faltblätter vermittelter Protein-Protein-Wechselwirkungen unterstützen.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.




















































