Wie SARS-Coronaviren die menschliche Zelle zum eigenen Vorteil umfunktionieren
Andere Coronaviren verfügen nicht über diesen Mechanismus
Coronavirus-Forscher um Prof. Rolf Hilgenfeld von der Universität zu Lübeck und Privatdozent Dr. Albrecht von Brunn von der Ludwigs-Maximilians-Universität München, beides Forscher am Deutschen Zentrum für Infektionsforschung (DZIF), konnten einen Forschungserfolg im "EMBO Journal" publizieren: Sie fanden heraus, wie SARS-Viren die Herstellung viraler Proteine in infizierten Zellen so anregen, dass viele neue Kopien des Virus gebildet werden können. Andere Coronaviren als SARS-CoV und SARS-CoV-2 verfügen nicht über diesen Mechanismus, so dass hier eine Erklärung für die ungleich höhere Pathogenität der SARS-Viren liegen könnte.
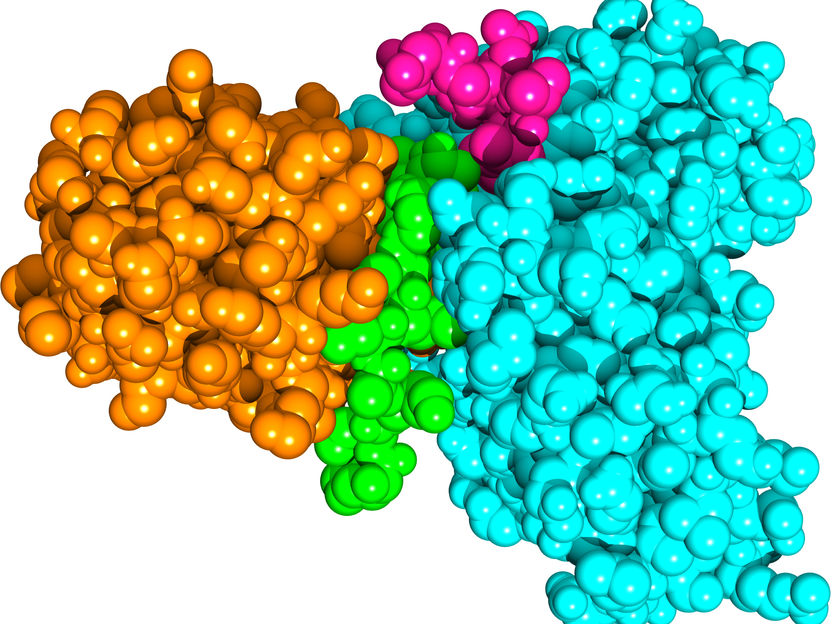
Das SUD-Protein des SARS-Coronavirus (orange) bildet einen Komplex mit dem menschlichen Protein Paip-1 (hellblau). Die besonders stark wechselwirkenden Elemente der beiden Proteine sind grün (SUD) bzw. violett (Paip-1) dargestellt.
Copyright: J. Lei et al., 2021 / EMBO Journal
Seit mehr als 50 Jahren sind Coronaviren bekannt, die beim Menschen harmlose Erkältungskrankheiten auslösen. Mit dem SARS-Coronavirus trat 2002/2003 erstmals ein Coronavirus auf, welches bei Infizierten zu schweren Lungenerkrankungen führte. Beim Vergleich der RNA-Genome von für den Menschen harmlosen Coronaviren und dem des SARS-Virus stießen Forscher auf eine Region, die nur in letzterem vorkam und deswegen "SARS-unique Domain" (SUD) genannt wurde.
Solche Genregionen und ihre Proteinprodukte könnten mit der außerordentlichen Pathogenität des SARS-Coronavirus und seines jüngsten Verwandten, des COVID-19-Virus SARS-CoV-2, in Zusammenhang stehen.
Die Arbeitsgruppen von Hilgenfeld und von Brunn zeigten, dass das SUD-Protein der Viren wechselwirkt mit einem menschlichen Protein namens Paip-1, welches wiederum an den ersten Schritten der Proteinbiosynthese beteiligt ist. Zusammen mit Paip-1 und anderen Proteinen der menschlichen Zelle bindet SUD offenbar an die Proteinsynthesefabrik der Wirtszelle, die Ribosomen, und steigert so die Herstellung aller Proteine. Dadurch würden alle Proteine, sowohl die der menschlichen Zelle als auch die des Virus, in verstärktem Maße hergestellt. Doch werden in mit SARS-CoV oder SARS-CoV-2 infizierten Zellen die Boten-RNA-Moleküle, die menschliche Proteine kodieren, durch das Virus gezielt zerstört, und zwar durch ein virales Protein namens Nsp1. Als Folge dieses komplizierten Prozesses produziert die infizierte Zelle dann überwiegend virale Proteine, so dass viele neue Kopien des Virus gebildet werden können.
Die Arbeitsgruppe von Albrecht von Brunn hatte die Wechselwirkung zwischen den Proteinen SUD und Paip1 vor mehreren Jahren entdeckt. "Als erfahrener Coronavirus-Forscher wusste ich, dass man die Besonderheiten des SARS-Coronavirus-Genoms anschauen muss, wenn man dieses Virus verstehen will", sagt Albrecht von Brunn.
Die Entdeckung aus München war von höchstem Interesse für Hilgenfeld, dessen Arbeitsgruppe bereits früher die dreidimensionale Struktur des SUD-Proteins aufgeklärt hatte, und die beiden Arbeitsgruppen taten sich zusammen. Dr. Jian Lei in Hilgenfelds Gruppe, inzwischen Gruppenleiter an der Sichuan University in Chengdu (China), gelang es, den Komplex aus SUD und Paip1 zu kristallisieren und seine dreidimensionale Struktur mittels Röntgenstrukturanalyse aufzuklären. Und Co-Erstautorin Dr. Yue "Lizzy" Ma-Lauer in von Brunns Gruppe charakterisierte den Komplex der beiden Proteine und seine Funktion durch eine Vielzahl von zellbiologischen und biophysikalischen Methoden.
"Derartige Wechselwirkungsstudien zwischen Coronavirusproteinen und Proteinen der infizierten menschlichen Zelle werden uns helfen zu verstehen, wie sich die Viren Schlüsselfunktionen der Wirtszelle zunutze machen", freut sich Hilgenfeld über die neuen Ergebnisse.























































