Zelluläre Immuntherapien effizienter und sicherer produzieren
Neuartige, nicht auf Viren basierende Genfähre entwickelt
Immunzellen, die außerhalb des Körpers mit therapeutisch wichtigen Genen ausgestattet werden, gelten als vielversprechender neuer Behandlungsansatz in der Onkologie. Doch die bisherigen auf Viren basierenden Herstellungsverfahren sind teuer und zeitaufwändig. Wissenschaftler im Deutschen Krebsforschungszentrum (DKFZ) haben eine neuartige, nicht auf Viren basierende Genfähre entwickelt, um therapeutische Gene in Immunzellen einzuschleusen. Mit dieser Genfähre ausgestattete therapeutische T-Zellen konnten am Nationalen Centrum für Tumorerkrankungen (NCT) Heidelberg Krebs effizienter bekämpfen als mit der herkömmlichen Methode hergestellte Zelltherapien.
Harbottle/DKFZ
Wie lassen sich Tumoren immunologisch bekämpfen, die für das Immunsystem eigentlich unsichtbar sind? Eine Lösung für dieses Problem ist die bereits etablierte CAR-T-Zell-Therapie: Bei diesem Verfahren werden patienteneigene T-Zellen außerhalb des Körpers mit den Genen für ein synthetisches Rezeptorprotein ausgestattet, das an ein auf Tumorzellen vorhandenes Oberflächenmolekül bindet. Die gentherapeutisch ausgerüsteten T-Zellen werden dem Patienten anschließend zurückgegeben und können dann gezielt Tumorzellen attackieren.
Bei einigen Blutkrebsarten haben sich CAR-T-Zelltherapien bereits als außerordentlich erfolgreich erwiesen mit Ansprechraten von über 80 Prozent. Mehrere CAR-T-Zellprodukte sind bereits für die klinische Anwendung zugelassen. „Es sind zahlreiche weitere Einsatzgebiete für CAR-T-Zellen denkbar, aber ihre Herstellung ist bislang sehr teuer und zeitaufwändig", sagt Patrick Schmidt vom NCT Heidelberg.
Bislang werden die Gene für den synthetischen Rezeptor üblicherweise mit Viren als „Gentaxis" in die T-Zellen eingeschleust. Doch das kann Nachteile haben: Die verwendeten Retroviren beispielsweise integrieren sich in das Erbgut der T-Zellen und können dabei unter Umständen gefährliche Mutationen auslösen. Eine Übertragung der Gene als nackte DNA – als so genannte „Plasmide" – schied bislang aus, da T-Zellen außerordentlich empfindlich auf fremde DNA-Moleküle reagieren.
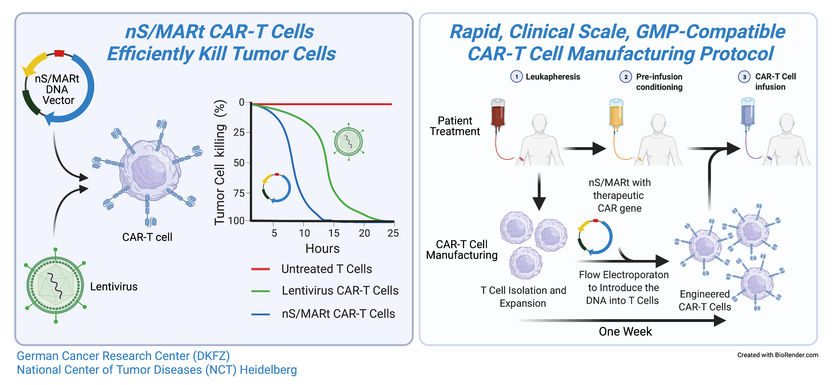
Matthias Bozza und Richard Harbottle vom DKFZ haben in langjähriger Entwicklungsarbeit eine völlig neuartige und patentgeschützte Plasmid-Genfähre entwickelt, die von den T-Zellen akzeptiert wird: Das DNA-Konstrukt integriert sich nicht ins Erbgut, sondern vermehrt sich autonom im Zellkern und wird so bei der Teilung der T-Zellen auf die Tochterzellen übertragen.
Die Forscher nutzten dazu eine bestimmte Region aus dem menschlichen Erbgut, die dazu dient, das DNA-Konstrukt an den Matrixproteinen des Zellkerns anzuheften. Dieses Konstrukt, genannt Nano S/MARt-Vector, überarbeiteten sie systematisch, um alle problematischen Komponenten zu entfernen, die Immunreaktionen der T-Zellen auslösen könnten. Außerdem steigerten sie dabei zugleich die Effizienz, mit der das übertragene Gen in der T-Zelle abgelesen wird. „Wir haben jede Komponente des DNA-Konstrukts optimiert und so einen Plasmid-Vektor geschaffen, der für die Zellen nahezu unsichtbar und daher hervorragend geeignet ist, um Genmaterial effizient in menschliche Zellen einzuschleusen", erklärt Matthias Bozza, Erstautor der Arbeit.
Das Nano S/MARt Vector-Konstrukt kann mit einem gängigen, schnellen und einfachen Verfahren, der Elektroporation, auf T-Zellen übertragen werden. Den Heidelberger Forschern gelang es, mit einem halbautomatischen Produktionssystem innerhalb von nur fünf Tagen genügend CAR-T-Zellen zu generieren, die das synthetische Rezeptorprotein ausbildeten, um Patienten zu behandeln. „Das ist eine bedeutende Verbesserung gegenüber den virusbasierten Verfahren, bei denen man mit einer Herstellungszeit von etwa drei Wochen rechnen muss", sagt Patrick Schmidt, der die Technologie als einer der beiden Studienleiter erprobt hat.
Die mit dem Nano S/MARt Vector produzierten CAR-T-Zellen erwiesen sich als effizientere Krebs-Killer als die mit Viren generierten Vergleichszellen. Dies galt sowohl für Experimente mit Tumorzellen in der Kulturschale als auch in Mäusen, denen Tumoren übertragen worden waren.
„In der Onkologie gibt es ein großes Anwendungspotenzial für CAR-T-Zellen und auch für andere zelluläre Immuntherapien. Die Möglichkeit, mit einem sicheren Vektor solche therapeutischen Zellen schneller und kostengünstiger in großen Mengen herzustellen, ist ein entscheidender Schritt, um das Potenzial dieser innovativen Behandlungsform in Zukunft besser ausschöpfen zu können", sagt Studienleiter Richard Harbottle. „Die Vorteile des Nano S/MARt Vectorsystems sind so überzeugend, dass wir davon ausgehen, mit unserem Verfahren einen neuen Standard bei der Herstellung genveränderter Immunzellen gesetzt zu haben."
Originalveröffentlichung
Matthias Bozza, Alice De Roia, Margareta P. Correia, Aileen Berger, Alexandra Tuch, Andreas Schmidt, Inka Zörnig, Dirk Jäger, Patrick Schmidt & Richard P Harbottle; "A non-viral, non-integrating DNA Nanovector platform for the safe, rapid, and persistent manufacture of recombinant T Cells"; Science Advances; 2021