Wissenschaftler identifizieren molekularen Weg, der bewegten Zellen hilft, zielloses Umherirren zu vermeiden
Die Ergebnisse der Studie von Johns Hopkins Medicine haben möglicherweise Auswirkungen auf das Verständnis der Ausbreitung von Krebszellen
Bei der Arbeit mit Fruchtfliegen haben Wissenschaftler der Johns Hopkins Medicine einen neuen molekularen Weg identifiziert, der hilft, sich bewegende Zellen in bestimmte Richtungen zu lenken. Die miteinander verbundenen Proteine und Enzyme in diesem Weg wirken wie Steuer- und Ruderkomponenten, die die Zellen in Richtung eines "beabsichtigten" und nicht eines zufälligen Ziels steuern, sagen sie.
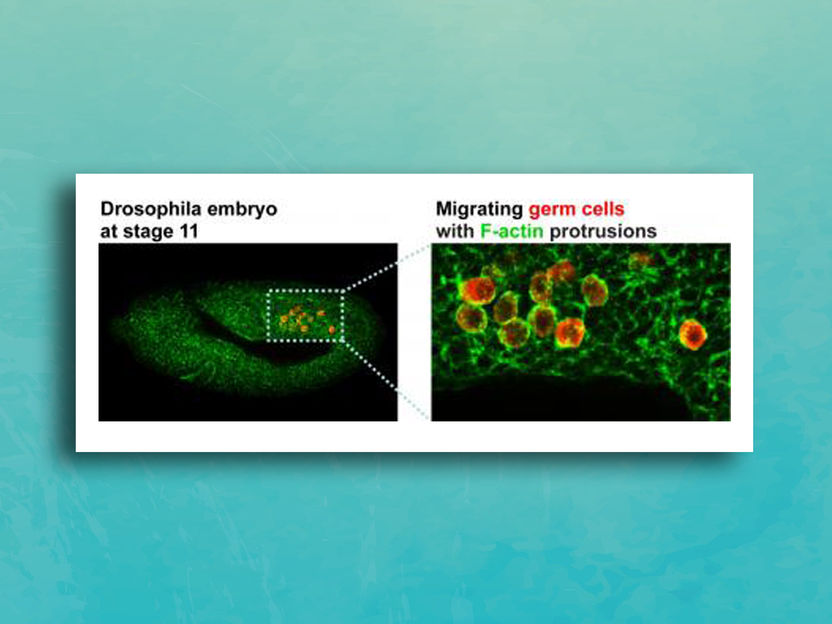
Wandernde Keimzellen in einem Fruchtfliegen-Embryo.
Deborah Andrew and JiHoon Kim, Johns Hopkins Medicine. | unsplash
In einem Bericht über die Arbeit, der am 2. März in Cell Reports veröffentlicht wurde, sagen die Wissenschaftler, dass dieselben molekularen Bahnen Krebszellen dazu bringen könnten, Metastasen zu bilden oder in entfernte Bereiche des Körpers zu wandern, und dass sie auch wichtig sein könnten, um zu verstehen, wie sich Zellen in einem Embryo zusammensetzen und wandern, um Organe und andere Strukturen zu bilden.
Das Team von Wissenschaftlern wurde von Deborah Andrew, Ph.D., Professorin für Zellbiologie und stellvertretende Direktorin für Fakultätsentwicklung für das Institut für grundlegende biomedizinische Wissenschaften an der Johns Hopkins University School of Medicine geleitet.
Andrew und ihre Kollegen begannen diese Forschung, als sie ein Gen namens Tre1 und seine Rolle bei der Entwicklung von Speicheldrüsen in Fruchtfliegen untersuchten. Die Werkzeuge, um die Auswirkungen des An- und Ausschaltens des Gens zu untersuchen, waren nicht ideal, sagt sie. Daher erzeugten zwei Mitglieder des Teams, Dr. Caitlin Hanlon von der Quinnipiac University und Dr. JiHoon Kim von der Johns Hopkins University, Fruchtfliegen, denen der proteinkodierende Teil des Tre1-Gens fehlt. Das Paar versah das Tre1-Protein mit einer fluoreszierenden Markierung, um zu erfahren, wo es während wichtiger Entwicklungsschritte lokalisiert ist.
In Experimenten mit Fruchtfliegenembryonen, die ein intaktes Tre1-Gen tragen, wandern die Zellen, die zukünftige Generationen des Organismus produzieren, die sogenannten Keimzellen, korrekt zum Geschlechtsorgan, der Gonade.
"Ohne das Tre1-Gen trafen die meisten Keimzellen jedoch nicht auf andere Nicht-Keimzellen oder somatische Zellen der Keimdrüse", sagt Andrew. "Die korrekte Navigation der Keimzellen ist wichtig, um sicherzustellen, dass zukünftige Generationen des Organismus stattfinden."
Es ist nicht das erste Mal, dass Wissenschaftler die Bedeutung von Tre1 bei der Keimzellnavigation feststellen. Zwei Forscherteams von der Indiana University und dem Massachusetts Institute of Technology hatten den Zusammenhang bereits früher hergestellt. Allerdings, so Andrew, blieben Fragen offen, was im Inneren der Keimzellen passiert, um die Zellen an den richtigen Ort zu bringen, sobald Tre1 aktiviert ist.
Es war bereits bekannt, dass das Tre1-Gen für ein Protein kodiert, das die Zellmembran mehrfach überspannt und an die Zelloberfläche stößt. Es gehört zu einer großen Familie von Proteinen, den sogenannten G-Protein-gekoppelten Rezeptoren, die es den Zellen ermöglichen, zu kommunizieren und auf Signale von anderen Zellen sowie auf Licht- und Geruchsreize zu reagieren. Fast 35 % der von der FDA zugelassenen Medikamente zielen auf G-Protein-gekoppelte Rezeptoren ab, sagt Andrew.
Um die molekularen Ereignisse, die Tre1 nachgeschaltet sind, genauer zu verfolgen, nutzte Kim, wissenschaftlicher Mitarbeiter und Postdoktorand an der Johns Hopkins University School of Medicine, Gewebekulturen von Fruchtfliegenzellen, um die Position von fluoreszierend markierten Molekülen zu finden, die möglicherweise durch das aktivierte Tre1-Protein ausgelöst werden. In den Gewebekulturen und Keimzellen lebender Fliegen deckte Kim den nachgeschalteten genetischen Pfad auf.
Er fand heraus, dass Tre1 als Steuermann der Zelle fungiert und die Steuerung der Zelle kontrolliert. Tre1 aktiviert die Steuer- und Ruderkomponenten der Zelle, indem es eine Kaskade von Proteinen und Enzymen antreibt, darunter eine Phospho-Inositol-Kinase, PI(4,5)P2, dPIP5K, dWIP und WASp.
Am Ende der molekularen Kaskade bildet sich eine Kette von Aktinproteinen in einer Ausstülpung am vorderen Rand der Zelle, um mechanische Kräfte für die Bewegung auszuüben.
Die Wissenschaftler suchten auch nach dem vorgeschalteten Signal, das Tre1 aktiviert. Sie benutzten ein gentechnisch verändertes Protein, das von Forschern der University of California, San Francisco, hergestellt wurde, um die Position eines Signalproteins namens Hedgehog zu verfolgen, das zuvor mit der Keimzellenwanderung in Verbindung gebracht wurde, obwohl seine Rolle in diesem Prozess umstritten war.
In Keimzellen erhöht die Hedgehog-Signalisierung die Membranspiegel eines Proteins namens Smoothened, das sich in der Vorwölbung der Zellen befindet, wo auch Tre1 zu finden ist.
Die Wissenschaftler planen, die Wege rund um Tre1 und die Verbindungen zwischen den an diesem Weg beteiligten Proteinen und Enzymen weiter zu untersuchen.
"Ein tieferes Verständnis darüber, wie sich bewegende Zellen navigieren und ausbreiten, hat das Potenzial, weitere Ziele für die Unterbrechung der Ausbreitung von Krebszellen zu liefern", sagt Andrew.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.