Auf dem Weg zu Wirkstoffen gegen altersbedingte Erkrankungen
Bayreuther Studie zur Aktivierung des Enzyms Sirtuin 6
Auf der Suche nach Wegen, altersbedingte Erkrankungen des Menschen effektiv zu bekämpfen, ist das Enzym Sirtuin 6 (Sirt6) in den Fokus der biochemischen Forschung gerückt. Eine gezielte Aktivierung von Sirt6 könnte derartige Erkrankungen, zum Beispiel einige Krebsarten, verhindern oder abschwächen. Biochemiker der Universität Bayreuth zeigen jetzt in einem Beitrag für die Zeitschrift „Nature Chemical Biology“, wie das Kleinmolekül MDL-801 an das Enzym Sirt6 bindet und dessen Aktivität beeinflusst. Diese Erkenntnisse fördern die Entwicklung neuer biomedizinischer Wirkstoffe.
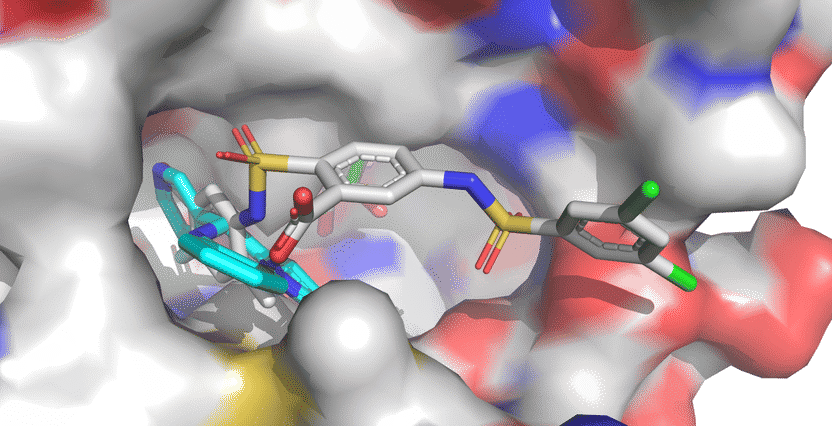
Die Sirt6-Aktivatoren UBCS039 (cyan, vorn li.) und MDL-801 (mehrfarbig, vorn re.) sind in derselben Bindungstasche von Sirt6 verankert. Das längere Molekül MDL-801 hat auch mit benachbarten Oberflächenbereichen Kontakt und interagiert stärker mit Sirt6.
Clemens Steegborn
Der Organismus des Menschen enthält sieben verschiedene Sirtuine, die als "Sirt1" bis "Sirt7" bezeichnet werden. Es handelt sich um Enzyme, die einen wesentlichen Anteil an der Regulierung des Stoffwechsels und der Regulierung von Stressreaktionen haben. Das Forschungsteam um Prof. Dr. Clemens Steegborn an der Universität Bayreuth hat in den letzten Jahren in mehreren Forschungsbeiträgen gezeigt, wie Sirt6 durch Kleinmoleküle aktiviert werden kann. Mit ihrer jetzt in „Nature Chemical Biology“ veröffentlichten Studie knüpfen Steegborn und sein wissenschaftlicher Mitarbeiter Dr. Weijie You direkt an diese Erkenntnisse an. Sie haben herausgefunden, dass das Molekül MDL-801 mit Sirt6 interagiert, indem es eine strukturelle Besonderheit dieses Enzyms nutzt: eine von außen gut zugängliche, ungewöhnlich weite Bindungstasche, die normalerweise an der Interaktion mit Substratproteinen beteiligt ist. Dieser molekulare Hohlraum setzt sich in einem offenen Kanal fort, der bis in das katalytische Zentrum von Sirt6 führt. In diesem für Sirt6 charakteristischen Kanal ist MDL-801 verankert, wenn es das Enzym aktiviert. Vor allem durch Aktivitätsstudien und Röntgenstrukturanalysen konnten Steegborn und You sowohl die Bindestelle als auch molekulare Prozesse identifizieren, die an der Aktivierung von Sirt6 durch MDL-801 beteiligt sind.
Wie die Bayreuther Biochemiker bereits in früheren Studien gezeigt haben, sind auch die Wirkstoffe UBCS039, Quercetin und Fluvastatin in der Lage, Sirt6 zu aktivieren. Sie nutzen dafür den gleichen offenen Kanal, in dem auch MDL-801 andockt. Dieser langgestreckte Hohlraum wird auch als Acylkanal bezeichnet. Denn sobald sich Sirt6 in einem aktivierten Zustand befindet, spaltet es Acylgruppen von Proteinen ab. Dadurch beeinflusst es unter anderem die von Genen gesteuerte Synthese von Proteinen. Erkenntnisse zur Aktivierung von Sirt6 bieten daher wertvolle Anhaltspunkte für die Entwicklung von Wirkstoffen, die altersbedingten Krankheiten – beispielsweise der Entstehung von Tumoren – entgegenwirken können.
„Alle Kleinmoleküle, für die wir bisher eine aktivierende Wirkung auf Sirt6 nachweisen konnten, nutzen den Acylkanal, um an Sirtuin 6 zu binden. Und obwohl sie chemisch zum Teil sehr unterschiedlich sind, tun sie dies auf sehr ähnliche Weisen. Das eröffnet uns die Chance, die Details ihrer jeweiligen Wechselwirkungen für das Feintuning biochemischer Wirkstoffe zu nutzen. Diese Wirkstoffe sind dann imstande, Sirt6 auf eine spezifische Weise zu regulieren. So können sie zielgenau zur Vorbeugung oder Heilung von Erkrankungen eingesetzt werden, die mit Alterungsprozessen in Zusammenhang stehen“, sagt Steegborn.
Mit ihrer neuen Studie widerlegen Steegborn und You eine wesentliche Aussage, die eine Forschungsgruppe in Shanghai im Jahr 2018 in „Nature Chemical Biology“ publiziert hat (DOI: 10.1038/s41589-018-0150-0). In diesem Beitrag wurde MDL-801 als neuer Sirt6-Aktivator beschrieben. Anhand einer röntgenkristallographischen Struktur sollte gezeigt werden, dass MDL-801 an einen anderen molekularen Abschnitt von Sirt6 bindet als andere Aktivatoren.„Diese Struktur, die durch eine falsche Interpretation von Messdaten zustandekam, hat seit ihrer Veröffentlichung zahlreiche Forschungsteams in die Irre geführt. Unsere Studie korrigiert diesen Fehler und macht es dadurch möglich, effizient an verbesserten Wirkstoffen zu arbeiten“, sagt Steegborn.