Hierarchische Dynamik
Forschende untersuchen die auf vielen Zeitskalen stattfindenden Signalübertragung in Proteinen
Ein Baum, der sich im Wind bewegt: Wie lange dauert es, bis die Bewegung eines Zweiges am Baumstamm ankommt? Und über welchen Weg überträgt sich diese Bewegung? Diese Fragen übertragen Forschende der Albert-Ludwigs-Universität auf Proteine, die molekularen Maschinerien der Zelle. Ein Team um Prof. Dr. Thorsten Hugel von Institut für Physikalische Chemie sowie Dr. Steffen Wolf und Prof. Dr. Gerhard Stock von Institut für Physik untersucht, wie die Signale, die in Proteinen strukturelle Veränderungen hervorrufen, von einem Ort zum anderen gelangen und wie schnell das geschieht. Da bei solchen Signalweiterleitungen viele Zeitskalen, von Nanosekunden bis Sekunden, involviert sind, konnten Wissenschaftlerinnen und Wissenschaftler den genauen Ablauf bisher nicht analysieren. Indem sie verschiedene Experimente, Simulationen und theoretische Studien kombiniert haben, ist es den Freiburger Forschern nun aber gelungen. Ihre Ergebnisse veröffentlichten sie in der Fachzeitschrift Chemical Science.
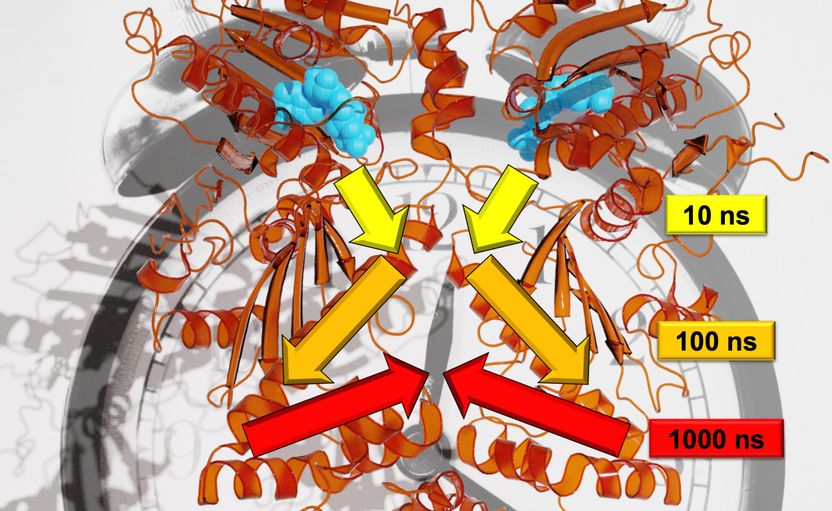
Freiburger Forschende konnten den genauen Ablauf von Signalweiterleitungen auf viele Zeitskalen nachvollziehen.
Steffen Wolf
Im Gegensatz zu Bäumen laufen Bewegungen bei dem für die Studie untersuchten Protein Hsp90 auf logarithmischen Zeitskalen ab: Jede größere Bewegung braucht etwa zehnmal so lange wie die kleinen einzelnen Bewegungen, aus denen die größere besteht. „So würde sich zum Beispiel ein Zweig im Sekundentakt, der Ast im 10-Sekundentakt und der Stamm im 100-Sekundentakt bewegen“, erläutert Wolf. Die unterschiedlichen Untersuchungsmethoden ermöglichten den Forschenden, eine allosterische Wechselwirkung zu beschreiben, also zu zeigen, wie ein Reaktionsprozess in Hsp90 eine entfernte Proteinbindungsstelle verändert. Das Team fand heraus, dass dieser allosterische Prozess über eine hierarchische Dynamik erfolgt, die Zeitskalen von Nano- bis Millisekunden und Längenskalen von Pico- bis zu mehreren Nanometern umfasst, so Stock.
Zudem ist der Reaktionsprozess in Hsp90 an eine Strukturveränderung der einzelnen Aminosäure Arg380 gekoppelt. Arg380 leitet wiederum die Strukturinformationen an eine Subdomäne des Proteins und schließlich an das gesamte Protein weiter. Die sich daraus ergebene veränderte Struktur schließt eine zentrale Bindungsstelle des Proteins, und ermöglicht dadurch, neue Funktionen zu erfüllen. Die Freiburger Forscher nehmen an, dass ähnliche hierarchische Mechanismen, wie dieser im Protein Hsp90 nachgewiesene, auch bei der Signalübertragung in anderen Proteine von grundlegender Bedeutung sind. Dies könnte für die Kontrolle von Proteinen durch Medikamenten nützlich sein, so Hugel.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Antibody Stabilizer von CANDOR Bioscience
Protein- und Antikörperstabilisierung leicht gemacht
Langzeitlagerung ohne Einfrieren – Einfache Anwendung, zuverlässiger Schutz

DynaPro NanoStar II von Wyatt Technology
NanoStar II: DLS und SLS mit Touch-Bedienung
Größe, Partikelkonzentration und mehr für Proteine, Viren und andere Biomoleküle

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.