Biobasierter Thrombosewirkstoff
Dreifach wirkende Thrombin-Hemmstoffe aus Insektenspeichel-Proteinen
Herzinfarkte und Embolien gehen häufig auf eine Thrombose, also die Blockade wichtiger Blutgefäße zurück. Wissenschaftler:innen haben nun erstmals einen Hemmstoff gegen das Thrombose auslösende Enzym Thrombin entwickelt, der dreifach wirksam ist. In einer Studie in der Zeitschrift Angewandte Chemie zeigen die Autoren:innen, dass der Wirkstoff drei Zentren des Thrombinmolekül gleichzeitig angreift und damit effizienter ist als ähnliche, rein natürliche Stoffe, die nur zwei Zentren abdecken.
Das Enzym Thrombin ist normalerweise dazu da, bei einer frischen Wunde die Gerinnung von Blutplättchen und die Einlagerung von Fibrin zum Wundverschluss auszulösen. Leider kann eine unkontrollierte Aktivität von Thrombin innerhalb von Blutgefäßen zur gefürchteten Blockade führen – eine tödliche Gefahr für Betroffene. Thrombotische Komplikationen sind erst vor kurzem iim Zusammenhang mit schweren Covid-19-Verläufen in den Vordergrund gerückt.
Viele stechende und blutsaugende Insekten setzen auf natürliche Thrombosehemmstoffe, um die Blutgerinnung im Einstichkanal zu stoppen. Einige davon wurden zu Medikamenten: Das am häufigsten eingesetzte, gegen Thrombin gerichtete Antigerinnungsmittel ist Hirudin, ein aus Blutegeln isoliertes Peptid.
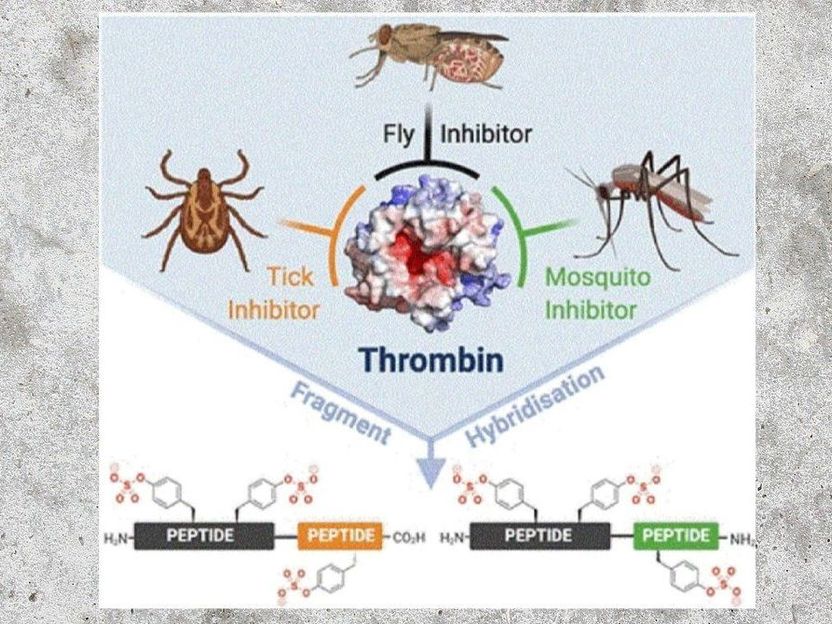
Auf der Suche nach stärkeren Wirkstoffen nahmen nun der Chemiker Richard J. Payne von der Universität Sydney (Australien) und ein internationales Team von Wissenschaftler:innen die Wirkungsweise der Thrombin-Hemmstoffe unter die Lupe. Natürliche Wirkstoffe aus Insektenspeichel blockieren am Thrombin normalerweise zwei von drei wichtigen Bereichen, nämlich die Stelle der Substratspaltung plus eine von zwei Regionen auf der Oberfläche des Enzyms, die für die Regulation der Gerinnung wichtig sind.
Um alle drei Zentren gleichzeitig zu erreichen, verknüpften die Wissenschaftler:innen ein aus der Tsetse-Fliege isoliertes Peptid, den Tsetse-Thrombin-Inhibitor, oder kurz TTI, entweder mit dem Wirkstoff Variegin aus einer tropischen Zecke oder mit Anophelin, dem Hemmstoff der Malaria-übertragenden Anopheles-Stechmücke. Die hybriden Peptide sollten nun jeweils alle drei Bindungsstellen von Thrombin überspannen.
Das zeigte Wirkung: Nach Angaben der Autoren zeigten die „Konstrukte aus beiden Hybridreihen ausnehmend starke Thrombin-hemmende Aktivitäten“. Mit einer 30- und sogar 385-fach höheren Aktivität als das jeweilige Stammpeptid waren die TTI-Anophelin-Hybride besonders gute Thrombin-Hemmstoffe. Die anderen Hybride lieferten zwei- bis zehnfache Verbesserungen. Auch in menschlichem Plasma, wo Rückkopplungen und andere Faktoren den Test komplizierter machen, konnten die hybriden Peptide die wirkungsvoll die Neubildung von Thrombin und Plättchenaggregationen hemmen.
Um die Wirkstoffe auch im echten Körper zu testen, applizierten die Forscher:innen das TTI-Variegin-Konstrukt im Mausmodell. Dort ließen sie einen Thrombus mindestens mit der gleichen Effizienz schrumpfen wie Hirudin und senkte die Fibrineinlagerung. Die Gruppe hofft, dass ihre Arbeit nicht nur wirkungsvolle Geringungshemmer hervorbringt, sondern auch bei der Konzeption von anderen Peptid-basierten Wirkstoffen helfen wird.
Biobasierter Thrombosewirkstoff
Wiley-VCH
Meistgelesene News
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte

TiGenix NV - Löwen, Belgien
SuppreMol ernennt Dr. Robert Phelps zum Head of Business Development & Licensing
Funktionelle Magnetresonanztechniken verbessern Diagnostik von Hirntumoren

Bier gegen Krebs? - Wissenschaftler wollen Hopfeninhaltsstoffe gegen Krebs einsetzen
Feld-EPSP
4SC AG gibt klinische Fortschritte seiner Onkologie Pipeline bekannt
Kasseler Nano-Skalpell für zielgenaue Operationen innerhalb der Zelle - Anwender für molekulares Skalpell des Zentrum für Nanostrukturwissenschaften (CINSaT) gesucht
Dorothy_Hansine_Andersen