Neuer Ansatz erklärt, wie Proteinkomplexe Krebsgene regulieren
Effektivere und zielgerichtete Krebstherapien möglich
NUP98-Fusionsproteine verursachen Leukämie über bislang unbekannte molekulare Mechanismen. Eine in Nature Structural & Molecular Biology veröffentlichte Studie unter Leitung der Vetmeduni Vienna konnte nun einen wichtigen Teil dieser Mechanismen entschlüsseln. Ein möglicher Treiber für die Aktivierung von Leukämie-Genen ist demnach die sehr dynamische Komplexbildung von NUP89-Fusionsproteinen mit anderen Proteinen, eine sogenannte biomolekulare Kondensation. Diese Erkenntnis könnte dazu beitragen, effektivere und zielgerichtete Krebstherapien zu entwickeln, von denen insbesondere an einer akuten myeloischen Leukämie (AML) erkrankte Kinder profitieren könnten.
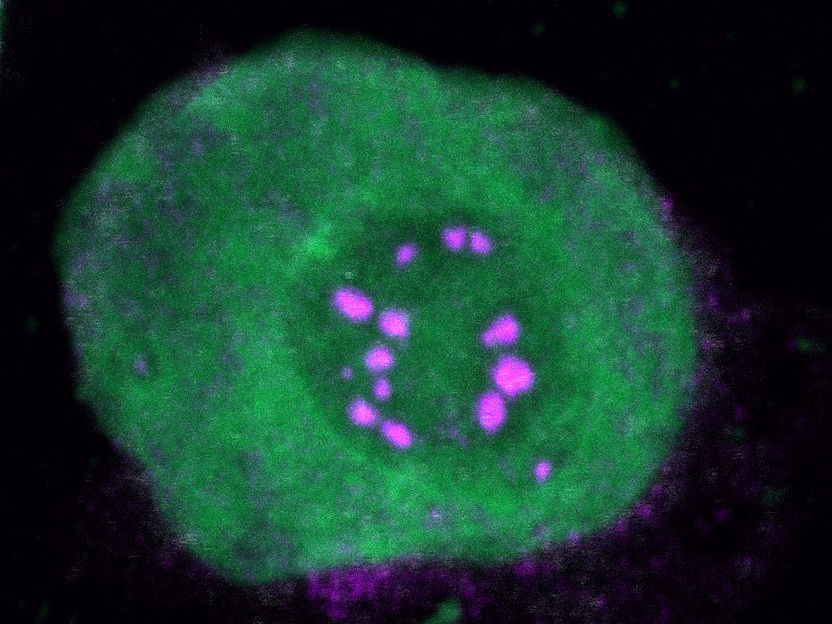
NUP98-Fusionsproteine
S. Terlecki-Zaniewicz/CCRI
Krebsassoziierte chromosomale Umlagerungen führen häufig zur Expression pathogener Fusionsproteine. Die Leukämie weist eine besonders hohe Häufigkeit von Fusionsonkogenen auf und die funktionelle Untersuchung von Leukämie-assoziierten Fusionsproteinen hat bis dato unschätzbare Einblicke in die molekularen Mechanismen der Krebsentstehung geliefert. Die Proteinkomplexe um Fusionsproteine spielen eine entscheidende Rolle bei der Gestaltung onkogener Genexpressionsmuster. Daher ist die Untersuchung von Proteinwechselwirkungen entscheidend, um neue Angriffspunkte zu identifizieren, auf deren Grundlage effektivere zielgerichtete Krebstherapien entwickelt werden können.
Sehr schlechte Prognose für an AML erkrankte Kinder
Während die häufigsten Leukämie-Fusionsproteine bereits umfassend charakterisiert wurden, fehlt bis dato ein funktionelles Verständnis der vielen seltenen Fusionen. Zusammengefasst finden sich seltene Fusionsproteine in einer signifikanten Anzahl von PatientInnen und viele der Betroffenen weisen nur sehr begrenzte Behandlungsmöglichkeiten auf. Bei der akuten myeloischen Leukämie (AML) mit NUP98-Fusionen ist der N-terminale Teil des Nucleoporin 98 (NUP98)-Gens mit über 30 verschiedenen C-terminalen Partner-Genen fusioniert. Während NUP98-Umlagerungen grundsätzlich selten sind (rund 2 % aller AML), sind sie in der pädiatrischen AML überrepräsentiert, und gehen mit einer besonders schlechten Prognose einher.
Wie NUP98-Fusionsproteine die AML antreiben
Alle NUP98-Fusionsproteine beinhalten eine intrinsisch ungeordnete Region (intrinsically disordered region; IDR) im NUP98-N-Terminus, welche durch Wiederholungen von Phenylalanin-Glycin (FG-repeats) charakterisiert ist. C-terminale Fusionspartner spielen häufig eine Rolle in der Kontrolle der Genexpression. Das Forschungsteam untersuchte deshalb, ob die Proteininteraktome von NUP98-Fusionsproteinen Aufschlüsse über Mechanismen der onkogenen Transformation liefern können. „Analysen von Affinitätsreinigung gekoppelt mit Massenspektrometrie sowie konfokale Bildgebung von fünf verschiedenen NUP98-Fusionsproteinen ergaben, dass sich unter den gemeinsamen Interaktionspartnern gehäuft Proteine fanden, die an der biomolekularen Kondensation beteiligt waren. Diese Interaktionspartner waren gemeinsam mit NUP98-Fusionsproteinen in charakteristischen Kondensaten im Zellkern lokalisiert“, so Studienleiter Florian Grebien, Leiter des Instituts für Medizinische Biochemie der Vetmeduni Vienna. Ein künstlich hergestelltes FG-Fusionsprotein kopierte die Kernlokalisierungsmuster von NUP98-Fusionsproteinen und ihre Fähigkeit, onkogene Genexpressionsprogramme voranzutreiben.
Neuer Ansatzpunkt für verbesserte Krebstherapien
Unter Verwendung einer neu entwickelten Methode (biotin-Isoxazol-vermittelte Kondensom-Massenspektrometrie, biCon-MS) fanden die Forscher zudem heraus, dass NUP98-Fusionsproteine die globale Zusammensetzung biomolekularer Kondensate verändern, um krebsspezifische Genexpressionsprogramme voranzutreiben. „Aufgrund der von uns gewonnenen Daten nehmen wir an, dass IDR-enthaltende Fusionsproteine die biomolekulare Kondensation mit der Transkriptionskontrolle kombinieren, um Krebs zu induzieren“, erklärt Erstautor Stefan Terlecki-Zaniewicz vom Institut für Medizinische Biochemie der Vetmeduni Vienna und der St. Anna Kinderkrebsforschung. Fehlgesteuerte biomolekularen Kondensation könnte folglich ein grundlegendes Prinzip der Krebsentwicklung sein, die von onkogenen Fusionsproteinen angetrieben wird. Dies könnte laut den Forschern ein neuer Ansatz sein, um effektivere und zielgerichtete Krebstherapien zu entwickeln.