Maßgeschneiderte menschliche Stammzellen
Ergebnisse stoßen neue Türen in der Forschung auf
induzierte pluripotente Stammzellen (iPS) haben das Potenzial, sich in die unterschiedlichsten Zelltypen und Gewebe zu verwandeln. Die „Kochrezepte“ für diese Umwandlung sind jedoch häufig kompliziert und schwer umsetzbar. Forscher des Zentrums für Regenerative Therapien Dresden (CRTD) der TU Dresden, der Harvard University (USA) und der Universität Bonn haben einen Weg gefunden, wie sich aus den iPS systematisch hunderte verschiedene Zellen schnell und einfach mit Hilfe von Transkriptionsfaktoren gewinnen lassen. Diese Quelle können Wissenschaftler über die Non-Profit-Organisation Addgene nutzen.
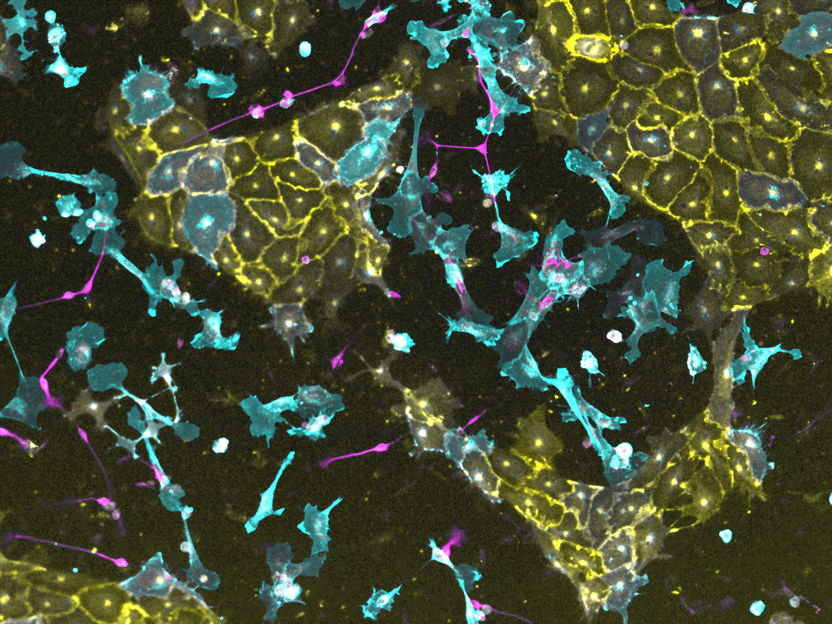
Drei transgene iPS-Linien, in denen jeweils ein anderer Transkriptionsfaktor aktivierbar ist, wurden gemischt und zu einem synthetischen Gewebe innerhalb von vier Tagen induziert. Gefäßzellen sind gelb, Nervenzellen magenta und Bindegewebszellen blau.
© Jesus Eduardo Rojo Arias und Volker Busskamp
Die Wissenschaftler verwendeten menschliche iPS, die aus Bindegewebszellen in einen quasi-embryonalen Zustand rückprogrammiert wurden. Im Prinzip lassen sich aus iPS-Zellen alle möglichen ausdifferenzierten Zellen gewinnen – von der Nerven- bis zur Blutgefäßzelle, wobei jedes Rezept maßgeschneidert ist. „Die meisten Differenzierungsprotokolle sind sehr aufwendig und kompliziert. Sie können aus den iPS nicht gleichzeitig und kontrolliert in einer Kultur verschiedene ausdifferenzierte Zellen gewinnen“, sagt Prof. Dr. Volker Busskamp, der zugleich zur Bonner Universitäts-Augenklinik, dem Exzellenzcluster ImmunoSensation2 der Universität Bonn, Exzellenzcluster Physik des Lebens (PoL) und zum CRTD der TU Dresden gehört.
Zusammen mit einem Team von der Harvard University, der TU Dresden und der Universität Bonn suchte er nach einem Weg, wie sich die komplizierten Verfahren durch einfache „Kochrezepte“ ersetzen lassen. Mit einem groß angelegten Screening fanden die Forscher insgesamt 290 DNA-bindende Proteine, die Stammzellen schnell und effizient zu Zielzellen umprogrammieren. Die Forscher wiesen nach, dass jeweils nur ein Transkriptionsfaktor genügt, um binnen vier Tagen aus den Stammzellen ausdifferenzierte Nerven-, Bindegewebs-, Blutgefäß- und Gliazellen zu züchten. Letztere ummanteln als „Isolatoren“ Gehirnzellen.
Ein genetisches Schaltbrett für die Stammzelldifferenzierung
Mit automatisierten Verfahren schleusten die Forscher die DNA-Sequenz für den jeweiligen Transkriptionsfaktor und weitere Steuerungselemente in das Erbgut der Stammzellen ein. Die Transkriptionsfaktoren konnten durch die Zugabe eines Moleküls aktiviert werden, und dadurch wandelte sich ein Teil der transgenen Stammzellen in ausdifferenzierte Zellen um. Stammzellen und ausdifferenzierte Zellen ließen sich durch Zellmarker unterscheiden und automatisch sortieren. Dann untersuchten die Forscher, wie viel eines bestimmten Transkriptionsfaktors in den ausdifferenzierten Zellen im Vergleich zu den Stammzellen vorlag. „Je größer der Unterschied, desto wichtiger scheint der jeweilige Transkriptionsfaktor für die Umwandlung der iPS in ausdifferenzierte Zellen zu sein“, erläutert Busskamp.
Auf diese Weise testete das Team insgesamt 1732 potenzielle Transkriptionsfaktoren an drei verschiedenen Stammzelllinien. Für 290 unterschiedliche Transkriptionsfaktoren fanden die Forscher dahingehend eine Wirkung, dass die iPS sich in ausdifferenzierte Zellen umwandelten. Das ist Neuland, weil diese Eigenschaft der iPS-Programmierung von 241 der entdeckten Transkriptionsfaktoren vorher nicht bekannt war. Am Beispiel der Nerven-, Bindegewebs-, Blutgefäß- und Gliazellen wiesen die Forscher mit verschiedenen Tests nach, dass die umgewandelten Zellen in ihrer Funktionsfähigkeit nahe an menschliche Körperzellen herankommen.
Die Ergebnisse stoßen neue Türen in der Forschung auf
„Der Vorteil der identifizierten Transkriptionsfaktoren besteht darin, dass sie besonders schnell und einfach iPS in Körperzellen umwandeln und sich daraus auch potenziell komplexere Gewebe bilden lassen“, sagt Busskamp. Was Wochen oder gar Monate dauerte, findet nun binnen Tagen statt. An Stelle aufwendiger und langwieriger Protokolle genügt bei den im Massen-Screening herausgefundenen Treffern nur ein Transkriptionsfaktor.
„Diese Ergebnisse stoßen neue Türen auf“, sagt Prof. Dr. George M. Church von der Harvard University. „Die Vielfalt, Einfachheit und Schnelligkeit der Stammzellprogrammierung anhand von Transkriptionsfaktoren ermöglicht Stammzellforschung in großem Stil. Weltweit arbeiten bereits 50 andere Gruppen mit unseren programmierbaren Stammzelllinien sowie mit der Transkriptionsfaktorsammlung.“ Die beiden Erstautoren Alex H.M. Ng und Parastoo Khoshaklagh aus Harvard haben mittlerweile das Startup GC Therapeutics in Cambridge (USA) gegründet, das programmierbare Stammzellen mit maßgeschneiderten, integrierten Transkriptionsfaktoren zur Verfügung stellt.
„Die Kooperation der verschiedenen Forschungseinrichtungen war sehr erfolgreich, da die unterschiedlichen Disziplinen sich sehr gut ergänzt und verzahnt haben“, sagt Busskamp. Wissenschaftler können nun weltweit die Transkriptionsfaktoren nutzen, weil diese über die Non-Profit-Organisation Addgene bereitgestellt werden.
Busskamp sieht gerade auch als Experte für Degenerative Netzhauterkrankungen in der Augenheilkunde ein großes Potenzial für die Stammzell-Technologie. „Für Erkrankungen, bei denen die Netzhaut zugrunde geht, wie etwa bei der Altersbedingten Makuladegeneration (AMD), besteht die Hoffnung, irgendwann einmal die betroffenen Sehzellen mit Hilfe der Umwandlung von iPS zu ersetzen“, sagt Busskamp. „Mein Team arbeitet darauf hin.“
Originalveröffentlichung
Alex H.M. Ng, Parastoo Khoshakhlagh, Jesus Eduardo Rojo Arias, Giovanni Pasquini, Kai Wang, Anka Swiersy, Seth L. Shipman, Evan Appleton, Kiavash Kiaee, Richie E. Kohman, Andyna Vernet, Matthew Dysart, Kathleen Leeper, Wren Saylor, Jeremy Huang, Amanda Graveline, Jussi Taipale, David E. Hill, Marc Vidal, Juan M. Melero-Martin, Volker Busskamp, George M. Church; "A comprehensive library of human transcription factors for cell fate engineering"; Nature Biotech; 2020