"Coole" Bakterien
Neue Einblicke in den Mechanismus, der die Fähigkeit zur Eisbildung von bakteriellen eisbildenden Proteinen in einer sauren Umgebung verringert
Aufgrund der milden Winter produzieren Skigebiete Kunstschnee, um den natürlichen Schneefall zu ergänzen oder die Skisaison zu verlängern. Sogenannte „Eisnukelations-Proteine“, die aus dem Bakterium Pseudomonas syringae extrahiert werden, können Wasser besser gefrieren lassen als jedes andere bekannte Material und werden bereits bei der Kunstschneeerzeugung verwendet. Forschende des Max-Planck-Instituts für Polymerforschung haben nun herausgefunden, warum eine saure Umgebung die Eisbildung durch diese Proteine hemmen kann.
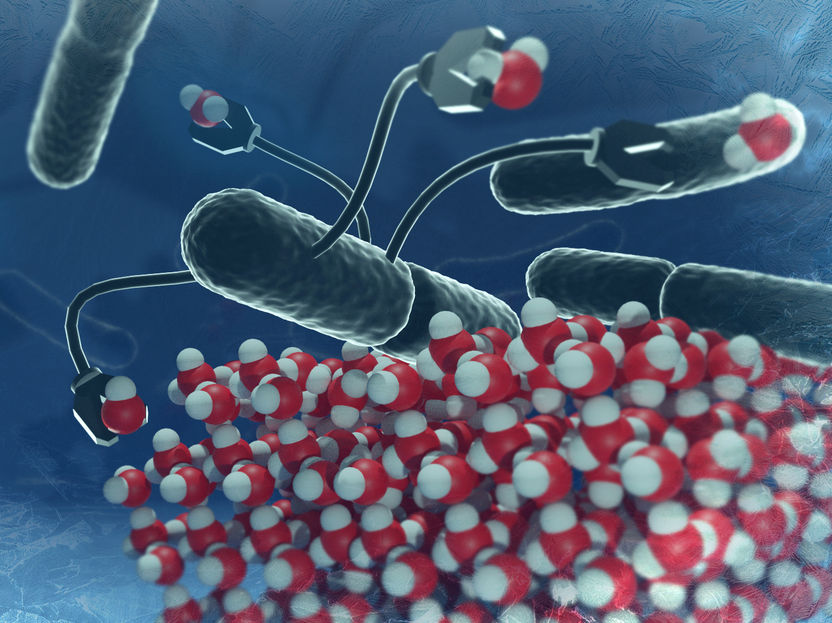
Saure Bedingungen verhindern, dass sich Eis-Nukleations-Proteine "richtig" organisieren, und beeinträchtigen somit die Eisbildung.
©MPI-P
Der Winter lehrt uns, dass Wasser bei Temperaturen unter 0 °C in Form von Eis und Schnee vorliegt. Sehr reines Wasser gefriert jedoch erst bei viel niedrigeren Temperaturen um −37 °C. Beim Gefrieren von Wasser bei höheren Temperaturen nahe 0 °C unterstützen das Wasser in der Regel sogenannte „Nukleationskeime“. Diese Nukleationskeime können beispielsweise Staub- und Rußpartikel oder eine spezielle Kategorie von Proteinen sein - lange Ketten von Molekülen die Aminosäuren enthalten und als „Eisnukelations-Proteine“ bezeichnet werden.
Die im natürlichen Bakterium Pseudomonas syringae enthaltenen Eisnukleations-Proteine sind die effizientesten unter allen bekannten Nukleationskeimen. Ihre Fähigkeit Eisbildung zu induzieren ist bekannt und wird bereits kommerziell zur Herstellung von Kunstschnee genutzt. Diese Proteine haben jedoch einen dunklen Ursprung: Das Bakterium ist bekannt für die schädliche Wirkung in Form von Erfrierungen, welches es auf verschiedenen pflanzlichen Kulturen hat. Es ist bekannt, dass saure Umgebungsbedingungen die Fähigkeit dieser Proteine zur Keimbildung von Eis verringern. Die Gruppe von Konrad Meister, Professor an der Universität von Alaska und Gruppenleiter am Max-Planck-Institut für Polymerforschung in Mainz, hat nun einen tieferen Einblick in die physikalischen Prozesse hinter diesem Effekt gewonnen.
Um das Gefrieren zu fördern, müssen sich mehrere dieser Eiskeimbildungsproteine in einer hochgeordneten Struktur anordnen, um die herum sich Wasser zu Eis gefrieren kann. Ein Grundprinzip dieses Ordnungsprozesses beruht auf der Abstoßung einzelner Proteine aufgrund ihrer elektrischen Ladung. Saure Umgebungsbedingungen können diese Abstoßung verringern und damit verhindern, dass sich die Eiskeimbildungsproteine "richtig" organisieren. Stattdessen begünstigen sie die Bildung eines ungeordneten „falschen“ Aggregats. Diese falsche angeordneten Eis-Nukleations-Proteine sind nicht in der Lage Eis bei so hohen Temperaturen wie gewöhnlich (nahe 0 °C) zu bilden.
"Das übergeordnete Ziel der Studie war es, die grundlegenden Mechanismen der bakteriellen Eisbildung zu verstehen. Die Möglichkeit, die Fähigkeit dieser Bakterien selektiv zu verringern, hat jedoch ein direktes Anwendungspotential", sagt Max Lukas, Hauptautor der Studie. „Es wäre zum Beispiel toll, wenn dieses Wissen genutzt werden könnte, um durch Erfrierungen verursachte Ernteverluste zu verringern, nicht zuletzt bei Weintrauben – einem sehr wichtigen Kultur- und Lebensmittelprodukt in und um Mainz."
Originalveröffentlichung
Meistgelesene News
Originalveröffentlichung
M. Lukas, R. Schwidetzky, A. T. Kunert, U. Pöschl, J. Fröhlich-Nowoisky, M. Bonn, and K. Meister; "Electrostatic Interactions Control the Functionality of Bacterial Ice Nucleators"; J. Am. Chem. Soc.; 2020
Organisationen
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Antibody Stabilizer von CANDOR Bioscience
Protein- und Antikörperstabilisierung leicht gemacht
Langzeitlagerung ohne Einfrieren – Einfache Anwendung, zuverlässiger Schutz

DynaPro NanoStar II von Wyatt Technology
NanoStar II: DLS und SLS mit Touch-Bedienung
Größe, Partikelkonzentration und mehr für Proteine, Viren und andere Biomoleküle

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte
Syngenta: EU-Bericht zu Insektizid-Risiko für Bienen hat fundamentale Fehler
Chips, die das Gehirn imitieren
„Bayer Early Excellence in Science Award“ 2010: 30.000 Euro für Nachwuchs-Forscher in Naturwissenschaften

Durchbruch in der wissenschaftlichen Bildgebung - Neue Methode zur Messung der Lumineszenzlöschung
Sartorius legt Geschäftszahlen für das 1. Halbjahr 2010 vor
Epigenomics AG: Europäisches Patentamt wird Schlüsselpatente erteilen - Patente schützen Biomarker mPITX2 für Anwendungen bei Prostata- und Brustkrebs

3D-Druck mit Ultraschall - Forschende entwickeln Technologie, die Schallwellen nutzt, um Materie in 3D zusammenzusetzen
Krebsstammzellen nachverfolgen - Was passiert innerhalb und zwischen einzelnen Zellen in den allerersten Stadien der Tumorentwicklung?
Die komplexesten Knoten in Proteinen - Theoretische Physiker stellen Googles künstliche Intelligenz AlphaFold auf die Probe und finden die bisher komplexesten Proteinknoten
Deutschlandweit größte Sammlung von ölabbauenden Mikroorganismen in Greifswald

Schlüssel für einen preiswerten und besser zugänglichen Hib-Impfstoff gefunden - Möglicher Ansatz für neue Impfstoffe und Medikamente gegen Bakterien




















































