Ein Wurzelbakterium gegen Alzheimer
Rhizolutin löst Amyloid β- und Tau-Aggregate auf
Ein Bakterium aus dem Erdbereich um die Wurzeln von Ginseng-Pflanzen könnte einen neuen Ansatz für eine Alzheimer-Therapie liefern: Rhizolutin, eine neuartige Verbindungsklasse mit trizyklischem Gerüst, löst mit der Alzheimer-Krankheit in Verbindung stehende Protein-Aggregate auch sowohl im Reagenzglas als auch in lebenden Organismen signifikant auf, wie Wissenschaftler in der Zeitschrift Angewandte Chemie berichten.
© Wiley-VCH
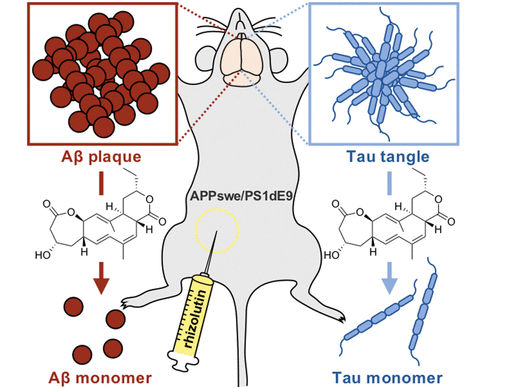
Der Bereich um die Wurzeln von Pflanzen ist ein komplexes Ökosystem mit vielfältigen Wechselwirkungen zwischen Pflanzen und diversen Mikroorganismen. Auf der Suche nach neuen Wirkstoffen wurde diese sogenannte Rhizosphäre bisher vernachlässigt, dabei hat sie Interessantes zu bieten. So hat ein Team um YoungSoo Kim (Yonsei University, Incheon, Rep. Korea) und Dong-Chan Oh (Seoul National University, Rep. Korea) einen als Rhizolutin bezeichneten Naturstoff identifiziert, der ein Ausgangspunkt für eine neuartige Therapie gegen Morbus Alzheimer sein könnte. Rhizolutin wird von einem Streptomyces-Stamm aus dem Wurzelbereich von Ginseng-Pflanzen produziert. Ginseng ist eine aus Asien stammende traditionelle Heilpflanze, deren Wurzeln als Stärkungsmittel gelten.
Durch Kultivierung in einem mit Ginseng-Pulver versetzten Medium gelang es den Forschern, die Rhizolutin-Produktion der Bakterien zu verzehnfachten, sodass sie die Struktur dieser neuartigen Verbindung aufklären konnten: Es handelt sich um ein bisher einzigartiges Gerüst aus drei verknüpften Ringen (ein 7/10/6-trizyklisches Dilacton aus einem Dimethylcyclodecatrien, das von einem sieben- und einem sechsgliedrigen Lacton-Ring flankiert wird).
Ein Screening von Naturstoff-Datenbanken ergab einen Treffer für Rhizolutin als möglichen Ausgangspunkt für einen Wirkstoff, der Amyloid-β (Aβ)-Plaques und Tau-Tangles, faserige Aggregate aus Tau-Proteinen, auflösen kann – beides typische Merkmale bei Alzheimer. Derartige Ablagerungen entstehen, wenn sogenannte Amyloid-β-Proteine auf eine falsche Weise zu β-Faltblättern gefaltet werden, die zu unlöslichen Plaques und Fasern aggregieren können. Diese führen zum Absterben von Nervenzellen, zu Nervenentzündungen, Hirnschwund und den damit verbundenen kognitiven Einschränkungen. Eine wirksame Behandlung von Alzheimer war bislang nicht in Sicht.
Anhand verschiedener in vitro und in vivo Versuche konnte das Team jetzt zeigen, dass Rhizolutin zu einer deutlichen Dissoziation unlöslicher Aβ- und Tau-Aggregate führt. In Kulturen von neuronalen und Glia-Zellen konnte Rhizolutin die durch Aβ hervorgerufenen Entzündungsvorgänge und das Absterben der Zellen deutlich verringern. Im Gehirn von Alzheimer-Mäusen war Rhizolutin in der Lage, vorhandene Aβ-Plaques signifikant aufzulösen. Der Vorgang scheint dabei ähnlich zu verlaufen wie die Entfernung falsch gefalteter Proteine bei einer Immuntherapie. Computersimulationen lassen vermuten, dass Rhizolutin in hydrophobe Bereich der aggregierten β-Faltblätter eindringt und so eine Dissoziation auslöst.
Originalveröffentlichung
Meistgelesene News
Originalveröffentlichung
Dr. Yun Kwon et al.; "Rhizolutin, a Novel 7/10/6‐Tricyclic Dilactone, Dissociates Misfolded Protein Aggregates and Reduces Apoptosis/Inflammation Associated with Alzheimer's Disease"; Angewandte Chemie International Edition; 2020
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte
Wie Proteine verklumpen - Molekulare Mechanismen bei der Aggregation von Proteinen in membranlosen Organellen

Forscher stellen Nanodiamanten her, die über die Haut medizinische und kosmetische Wirkstoffe abgeben können - Mithilfe fortschrittlicher optischer Technologie können die genaue Position und Konzentration von Nanodiamanten nicht-invasiv überwacht werden, so dass keine Biopsie erforderlich ist

17 Millionen für Krebsdiagnosen der Zukunft - inveox erhält weiteres Investment
Verjüngungskur fürs Gehirn - Zusätzliche Stammzellen verbessern Lernen und Gedächtnis von alten Mäusen
Von der Krebszelle zum Gehirntumor: Mikroskopie zeigt Bildung von Metastasen in Echtzeit
Genregulation schlägt auf den Magen - Max-Planck-Forschern gelingt mit neuer Technik Erfolg im Kampf gegen den Verursacher von Magengeschwüren und Magenkrebs
„Molekularer Klebstoff“ – Forschung an einer neuen Waffe gegen Krebstreiber - Wirkmechanismus einer neu entdeckten zellulären Krebsbremse aufgeklärt
Cargo-Verkehr im Zellfortsatz: IFT-Moleküle transportieren Frachtgut an Ort und Stelle - Mainzer Neurobiologen identifizieren und lokalisieren Transportmoleküle in Zellen der Netzhaut
Darmbein

Tosoh erhöht Produktionskapazität für Trenn- und Aufreinigungsmedien
Covid-19: Neue Energie für schlappe Immunzellen