Neue Klasse von hochwirksamen Hemmstoffen zum Schutz vor Neurodegeneration
Neurobiologen entschlüsseln im Mausmodell zentralen Mechanismus degenerativer Prozesse im Gehirn und entwickeln neues therapeutisches Wirkstoffprinzip
Wie ein spezieller Rezeptor, der in den Kontaktstellen der Nervenzellen üblicherweise ein genetisches Schutzprogramm anschaltet, außerhalb synaptischer Kontakte zum Nervenzelltod führen kann, haben Neurobiologen der Universität Heidelberg aufgeklärt. Ihre grundlegenden Erkenntnisse zu neurodegenerativen Prozessen führten die Forscher des Interdisziplinären Zentrums für Neurowissenschaften (IZN) zugleich zu einem völlig neuen therapeutischen Wirkstoffprinzip. Sie entdeckten eine neue Klasse von Hemmstoffen, die in Untersuchungen an Mausmodellen hochwirksam zum Schutz der Nervenzellen beitragen können. Diese neuartige Wirkstoffklasse eröffnet erstmals Perspektiven, um derzeit nicht behandelbare Erkrankungen des Nervensystems wirksam zu bekämpfen, wie Prof. Dr. Hilmar Bading betont.
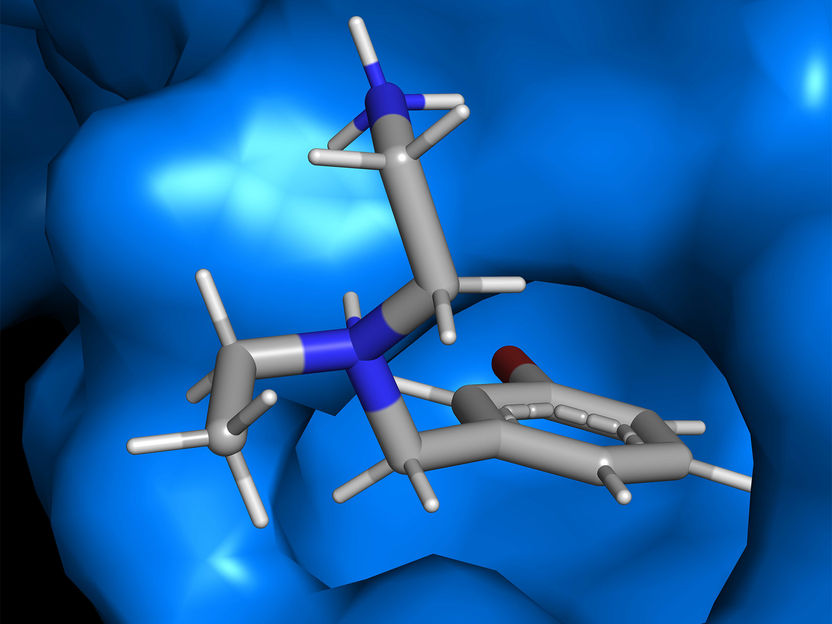
Interaktion des Interface Inhibitors Compound 8 innerhalb der Bindungstasche der Proteinkontaktfläche.
Hilmar Bading
Im Mittelpunkt der Forschungen von Prof. Bading und seinem Team steht der sogenannte NMDA-Rezeptor. Bei diesem Rezeptor handelt es sich um ein Ionenkanalprotein, das von einem biochemischen Botenstoff – dem Neurotransmitter Glutamat – aktiviert wird. Er sorgt dafür, das Kalzium in die Zelle einströmen kann. Das Kalziumsignal setzt in der Synapse Plastizitätsvorgänge in Gang, pflanzt sich aber auch bis in den Zellkern fort und schaltet dort ein genetisches Schutzprogramm an. Glutamat-aktivierte NMDA-Rezeptoren, die sich in den Kontaktstellen der Nervenzellen befinden, haben eine Schlüsselfunktion im Gehirn, da sie dort zu Lern- und Gedächtnisprozessen und Nervenzellschutz beitragen. Die gleichen Rezeptoren sind aber auch außerhalb synaptischer Kontakte zu finden. Diese extra-synaptischen NMDA-Rezeptoren stellen eine immanente Bedrohung dar, da ihre Aktivierung zum Zelltod führen kann. Normalerweise sorgen effiziente zelluläre Aufnahmesysteme für das Glutamat dafür, dass diese Rezeptoren nicht aktiviert werden und Nervenzellen unbeschädigt bleiben.
Bei Erkrankungen kann sich diese Situation dramatisch ändern. Werden etwa nach einem Schlaganfall Teile des Gehirns nicht ausreichend mit Sauerstoff versorgt, hebeln diese Störungen der Durchblutung die Glutamat-Aufnahmesysteme aus. Der Glutamat-Level außerhalb der Synapsen steigt an, wodurch die extra-synaptischen NMDA-Rezeptoren aktiviert werden. Die Folgen sind Nervenzellschädigungen und Nervenzelltod, die Einschränkungen der Gehirnfunktionen nach sich ziehen. Erhöhte Glutamat-Level außerhalb synaptischer Kontakte treten aber nicht nur bei Durchblutungsstörungen des Gehirns auf. „Es deutet vieles darauf hin, dass bei einer Reihe von neurodegenerativen Erkrankungen die toxischen Eigenschaften der extra-synaptischen NMDA-Rezeptoren eine zentrale Rolle spielen“, erläutert Prof. Bading. Nach Angaben des Wissenschaftlers betrifft dies vor allem Morbus Alzheimer und die Amyotrophe Lateralsklerose mit den Folgen Muskelschwäche und Muskelschwund sowie Netzhautdegenerationen, aber möglicherweise auch Gehirnschädigungen nach Infektionen mit Viren oder Parasiten.
Während die Glutamat-aktivierten NMDA-Rezeptoren in den Kontaktstellen der Nervenzellen zum Aufbau eines Nervenschutzschildes beitragen, werden sie außerhalb der Synapsen von Dr. Jekyll zu Mr. Hyde. „Zu verstehen, warum extra-synaptische NMDA Rezeptoren zum Nervenzelltod führen, ist der Schlüssel zur Entwicklung neuroprotektiver Therapien“, so Prof. Bading. Genau hier setzen die Heidelberger Neurobiologen an: Mit ihren Untersuchungen an Mausmodellen konnten sie zeigen, dass die NMDA-Rezeptoren, die sich außerhalb der synaptischen Kontakte befinden, mit einem anderen Ionenkanalprotein eine Art „Todeskomplex“ bilden. Dieses Protein mit der Bezeichnung TRPM4 hat vielfältige Funktionen im Körper und spielt zum Beispiel im Herz-Kreislauf-System oder bei der Immunantwort eine Rolle. Im Gehirn, so die neuen Erkenntnisse der Forscher um Hilmar Bading, verleiht TRPM4 den extra-synaptischen NMDA-Rezeptoren die toxischen Eigenschaften.
Die Wissenschaftler haben mithilfe molekularer und proteinbiochemischer Methoden die Kontaktflächen der beiden interagierenden Proteine identifiziert. Mit diesem Wissen konnten sie mit strukturbasierten Suchverfahren Substanzen ermitteln, die genau diese Verbindung auflösen und damit den „Todeskomplex“ zerlegen und inaktivieren können. Diese neue Klasse von Hemmstoffen – von den Heidelberger Forschern „Interface Inhibitoren“ genannt, da sie die Haftung der Kontaktflächen zwischen den extra-synaptischen NMDA-Rezeptoren und TRPM4 auflösen – erwiesen sich als hochwirksame Schutzfaktoren für Nervenzellen. „Wir arbeiten hier mit einem völlig neuen Wirkstoffprinzip. Mit den Interface Inhibitoren verfügen wir über ein Instrument, das die toxischen Eigenschaften von extra-synaptischen NMDA-Rezeptoren selektiv abtrennen kann“, erläutert Prof. Bading.
In Mausmodellen für Schlaganfall oder Netzhautdegeneration konnten Prof. Bading und sein Team bereits die Wirksamkeit der neuen Hemmstoffe aufzeigen. Nach den Worten des Heidelberger Wissenschaftlers besteht begründete Hoffnung, dass solche Interface Inhibitoren als oral verabreichbare Breitband-Neuroprotektiva perspektivisch Behandlungsmöglichkeiten für gegenwärtig nicht therapierbare neurodegenerative Erkrankungen bieten. „Bis zu einer möglichen Zulassung als Arzneimittel für den Menschen wird es jedoch noch mehrere Jahre dauern, da die neuen Wirkstoffe zunächst eine Reihe von präklinischen und klinischen Prüfphasen erfolgreich durchlaufen müssen.“