Die Kopplung unterbrechen
Echtzeitbeobachtung von Signalübertragung in Proteinen liefern neue Erkenntnisse für Medikamentenforschung
Proteine geben innerhalb des menschlichen Körpers Informationen und Signale, indem sie ihre Strukturen verändern: So binden zum Beispiel Hormone an für sie vorgesehene Zielproteine, wodurch sie dort eine Strukturveränderung hervorrufen, die wiederum an anderer Stelle auf der Oberfläche des Proteins neue Bindestellen für andere Proteine bildet. Diese Kopplung von unterschiedlichen, voneinander entfernten Bindestellen bezeichnen Forschende als Allosterie. Eine Unterbrechung dieser Kopplung führt dazu, dass Signale nicht weitergeleitet werden. Das kann durch gezielt dafür designte Moleküle erreicht werden, die dadurch pharmakologische Wirkung als Schmerzmittel oder Chemotherapeutikum erhalten. Um solche Moleküle zu bauen, müssen Wissenschaftler die möglichen Mechanismen von Allosterie kennen. Ein Team um Prof. Dr. Gerhard Stock aus der Arbeitsgruppe Biomolekulare Dynamik am Physikalischen Institut der Universität Freiburg und Prof. Dr. Peter Hamm vom Institut für Chemie der Universität Zürich/Schweiz liefern in der Fachzeitschrift PNAS dafür wichtige Einblicke.
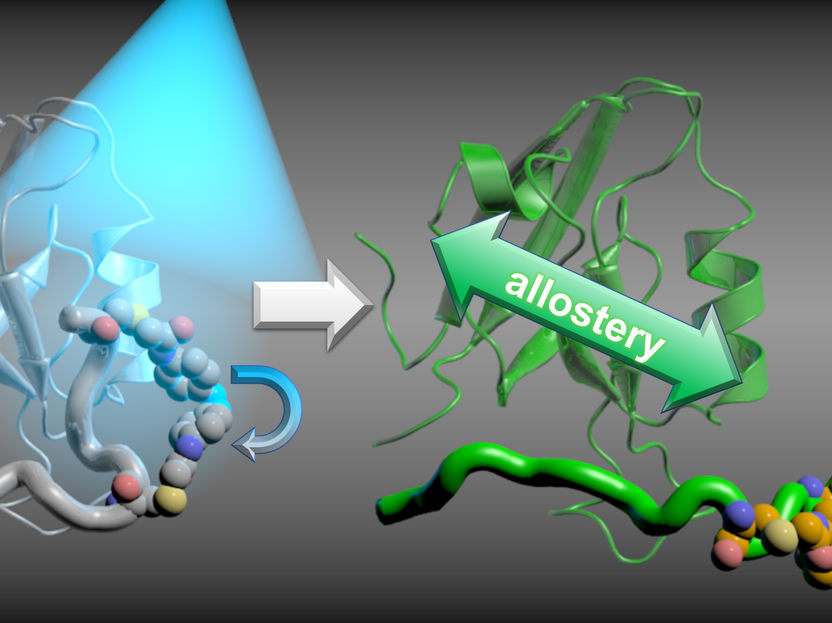
Informationen der Proteine: Eine Unterbrechung in diese Kopplung, der Allosterie, führt dazu, dass Signale nicht weitergeleitet werden.
Gerhard Stock, Steffen Wolf
Die Forscher haben zeitaufgelöst allosterische Veränderungen im Testprotein PDZ2 verfolgt, die durch die Bindung eines so genannten Liganden hervorgerufen werden – also eines Stoffes, der in der Lage ist, an ein Zielprotein anzudocken. Die Arbeitsgruppe der Universität Zürich führte hierzu zeitaufgelöste Vibrationsspektroskopie durch, die Physiker der Albert-Ludwigs-Universität simulierten am Tübinger Großrechner BinAC die entsprechenden Veränderungen auf atomistischer Ebene. Durch diese Kombination konnten die Wissenschaftler mit atomarer Auflösung und einem Zeitskalenbereich von Pico- bis Mikrosekunden nachvollziehen, wie eine Veränderung des Ligandenbindungsmodus durch das Protein läuft. Diese Echtzeitbeobachtung der Signalübertragung in Proteinen zeigte: Grundlage der Allosterie sind die Veränderungen sowohl der Struktur als auch der Dynamik des Proteins, die über hierarchische Zeitskalen verläuft. Deshalb braucht eine strukturelle Veränderung in etwa zehnmal länger als eine ihr vorangehende Veränderung.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!

Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!

























































