Streckbank für Zellen
Raffinierte, wenige Mikrometer kleine Vorrichtung macht es möglich, die Reaktion einzelner Zellen auf mechanischen Stress zu untersuchen
Das Verhalten von Zellen wird durch ihre Umgebung gesteuert. Neben biologischen Faktoren und chemischen Substanzen geraten auch physikalische Kräfte wie Druck oder Zug in den Fokus. Eine Methode, mit der sich der Einfluss äußerer Kräfte auf einzelne Zellen analysieren lässt, haben Forscher des Karlsruher Instituts für Technologie (KIT) und der Universität Heidelberg entwickelt. Mit einem 3D-Druckverfahren stellen sie Mikro-Gerüste her, auf deren jeweils vier Pfeilern sich eine Zelle ansiedelt. Auf ein äußeres Signal hin schwillt ein Hydrogel im Inneren des Gerüstes an und drückt die Pfeiler auseinander: Die Zelle muss sich „strecken“.

Elektronenmikroskopische Aufnahme des „leeren“ Gerüsts (ohne Hydrogel), mit dessen Hilfe ein internationales Forschungsteam einzelne Zellen deformiert hat.
Marc Hippler, KIT

Lichtmikroskopische Aufnahmen von gefärbten embryonalen Mauszellen im normalen (links) und im gestreckten Zustand (rechts). Die roten Pfeile verdeutlichen die einwirkenden Kräfte.
Marc Hippler, KIT

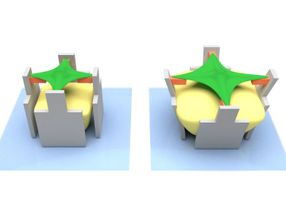
Viele zelluläre biologische Prozesse, wie etwa die Wundheilung oder die Entwicklung von Gewebe, werden stark von den Eigenschaften ihrer Umgebung beeinflusst. Zellen reagieren beispielsweise auf biologische Faktoren oder chemische Stoffe. Doch zunehmend geraten auch einwirkende physikalische Kräfte in den Blickpunkt der Forschung: Wie genau stellen sich die Zellen auf sie ein?
Das Team des Exzellenzclusters 3DMM2O hat im deutsch-japanischen Universitätskonsortium HeKKSaGOn und in Kooperation mit australischen Wissenschaftlern einen besonders raffinierten Weg beschritten, um sich dieser Frage zu nähern. Für die Herstellung ihrer Zell-Streckbänke nutzten sie das „direkte Laserschreiben“, ein spezielles 3D-Druckverfahren: Dabei wird ein Laserstrahl computergesteuert in eine spezielle flüssige Druckertinte fokussiert. Deren Moleküle reagieren nur an den beleuchteten Stellen und bilden dort ein festes Material. Alle anderen Bereiche bleiben flüssig und können weggewaschen werden. „Dieses Verfahren ist bei uns im Exzellenzcluster etabliert, um dreidimensionale Strukturen aufzubauen – auf der Mikrometerskala und darunter“, erläutert Marc Hippler vom Institut für Angewandte Physik des KIT, Erstautor der Veröffentlichung.
Im aktuellen Fall verwendeten die Forscher drei verschiedene Druckertinten: Eine Tinte aus protein-abweisendem Material, mit der sie das eigentliche Mikrogerüst herstellten. Mit einer zweiten Tinte aus protein-anziehendem Material fertigten sie anschließend vier Balken, die jeweils mit einem der Gerüstpfeiler verbunden sind. Auf diesen vier Balken verankert sich die Zelle. Eine dritte Tinte ist der eigentliche Clou: Die Wissenschaftler „drucken“ mit ihr eine Masse im Inneren des Gerüstes. Geben sie dann eine spezielle Flüssigkeit zu, dehnt sich die Hydrogel-Masse aus. Sie entwickelt so eine Kraft, die ausreicht, um die Pfeiler mitsamt den Balken zu bewegen – und somit die Zelle auf den Balken zu strecken.
Zellen wirken Deformation aktiv entgegen
Die Wissenschaftler des Exzellenzclusters haben zwei ganz verschiedene Zellarten auf ihre Mikro-Streckbank gelegt: humane Knochentumor-Zellen und embryonale Mäusezellen. Sie stellten fest, dass die Zellen den äußeren Kräften mit Motorproteinen aktiv entgegenwirken und ihre Zugkräfte so stark erhöhen. Wird die externe Streckung aufgehoben, so entspannen sich die Zellen wieder und kehren zu ihrem Ausgangszustand zurück. „Dieses Verhalten zeigt eindrucksvoll die Anpassungsfähigkeit an eine dynamische Umgebung. Wenn sich die Zellen nicht mehr erholen würden, wären sie nicht mehr in der Lage, ihre ursprüngliche Funktion – beispielsweise den Wundverschluss – zu erfüllen“, so Professor Martin Bastmeyer vom Zoologischen Institut des KIT.
Wie das Team weiter herausfand, spielt bei der Reaktion der Zellen auf die mechanische Stimulation ein Protein namens NM2A (NonMuscle Myosin 2A) eine entscheidende Rolle: Genetisch veränderte Knochentumor-Zellen, die NM2A nicht bilden können, waren kaum noch in der Lage, der äußeren Deformation entgegenzuwirken.
Originalveröffentlichung
Marc Hippler, Kai Weißenbruch, Kai Richler, Enrico D. Lemma, Masaki Nakahata, Benjamin Richter, Christopher Barner-Kowollik, Yoshinori Takashima, Akira Harada, Eva Blasco, Martin Wegener, Motomu Tanaka, Martin Bastmeyer; "Mechanical Stimulation of Single Cells by Reversible Host-Guest Interactions in 3D Micro-Scaffolds"; Science Advances; 2020
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Zellanalyse
Die Zellanalyse ermöglicht es uns, Zellen in ihren vielfältigen Facetten zu erforschen und zu verstehen. Von der Einzelzellanalyse über die Durchflusszytometrie bis hin zur Bildgebungstechnologie – die Zellanalyse bietet uns wertvolle Einblicke in die Struktur, Funktion und Interaktion von Zellen. Ob in der Medizin, der biologischen Forschung oder der Pharmakologie – die Zellanalyse revolutioniert unser Verständnis von Krankheiten, Entwicklung und Behandlungsmöglichkeiten.
Themenwelt Zellanalyse
Die Zellanalyse ermöglicht es uns, Zellen in ihren vielfältigen Facetten zu erforschen und zu verstehen. Von der Einzelzellanalyse über die Durchflusszytometrie bis hin zur Bildgebungstechnologie – die Zellanalyse bietet uns wertvolle Einblicke in die Struktur, Funktion und Interaktion von Zellen. Ob in der Medizin, der biologischen Forschung oder der Pharmakologie – die Zellanalyse revolutioniert unser Verständnis von Krankheiten, Entwicklung und Behandlungsmöglichkeiten.