Glykane im SARS-CoV-2-Spike-Protein spielen eine aktive Rolle bei der Infektion
Ergebnisse legen den Grundstein für neue Strategien zur Bekämpfung der Pandemie-Bedrohung
Während die COVID-19-Pandemie wütet, machen Forscher Überstunden, um Impfstoffe und Therapien zu entwickeln, die SARS-CoV-2, das für die Krankheit verantwortliche Virus, vereiteln sollen. Viele Bemühungen konzentrieren sich auf das Coronavirus-Spike-Protein, das das Angiotensin-konvertierende Enzym 2 (ACE2) auf menschlichen Zellen bindet, um dem Virus den Eintritt zu ermöglichen. Nun haben Forscher, die im ACS Central Science berichten, eine aktive Rolle von Glykanen - Zuckermoleküle, die Proteine schmücken können - in diesem Prozess aufgedeckt und Ziele für Impfstoffe und Therapien vorgeschlagen.
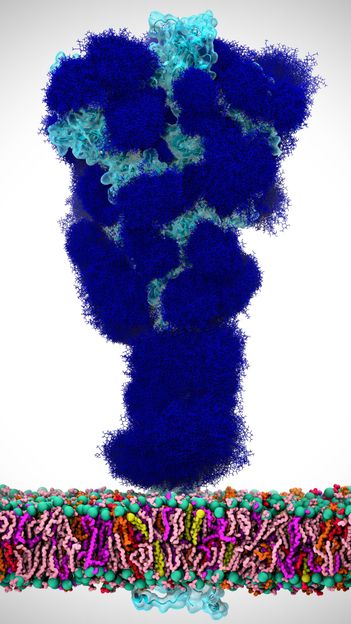
In dieser Abbildung umhüllen Glykane (dunkelblau) das SARS-CoV-2-Spike-Protein (hellblau), das in der Virushülle verankert ist (bunte Doppelschicht auf der Unterseite).
Adapted from ACS Central Science 2020, DOI: 10.1021/acscentsci.0c01056
Bevor das SARS-CoV-2-Spike-Protein auf einer menschlichen Zelle mit ACE2 interagieren kann, verändert es seine Form, um seine Rezeptorbindungsdomäne (RBD) freizulegen, den Teil des Proteins, der mit ACE2 interagiert. Wie viele virale Proteine hat das SARS-CoV-2-Spike-Protein eine dicke Schicht von Glykanen auf seiner Oberfläche. Diese Glykane, die an spezifischen Stellen angebracht sind, tragen dazu bei, die viralen Proteine vor dem Immunsystem des Wirts zu schützen. Rommie Amaro und seine Kollegen von der University of California San Diego, der Maynooth University (Irland) und der University of Texas in Austin fragten sich, ob bestimmte Glykane im SARS-CoV-2-Spike-Protein ebenfalls aktiv an dem Prozess beteiligt sein könnten, der zur Infektion führt.
Um dies herauszufinden, verwendeten die Forscher strukturelle und glykomische Daten, um molekulardynamische Simulationen des in die Virusmembran eingebetteten SARS-CoV-2-Spike-Proteins zu erstellen. Die Computermodelle, die eine detaillierte Momentaufnahme jedes Atoms im Spike-Glykoprotein darstellten, zeigten, dass N-Glykane, die an bestimmten Stellen mit dem Spike-Protein verbunden sind (N165 und N234), dazu beitragen, die Formveränderung zu stabilisieren, die die RBD freilegt, was zur Förderung der Infektion beitragen könnte. Die Simulationen identifizierten auch Regionen des Spike-Proteins, die nicht von Glykanen umhüllt waren und daher anfällig für Antikörper sein könnten, insbesondere nach der Formveränderung. In Laborexperimenten mit Biolayer-Interferometrie zeigte das Team, dass die Mutation des Spike-Proteins, so dass es keine Glykane mehr an N165 und N234 hatte, die Bindung an ACE2 verringerte. Diese Ergebnisse legten den Grundstein für neue Strategien zur Bekämpfung der pandemischen Bedrohung, sagen die Forscher.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.





















































