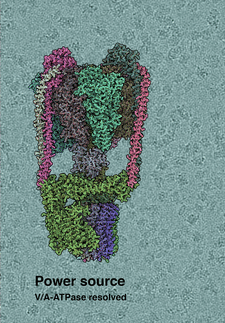Struktur von ATPase, der kleinsten Turbine der Welt, gelöst
Position der Permeabilitäts-Übergangspore gefunden
ATP, kurz für Adenosintriphosphat, ist der Brennstoff des Lebens. ATP kommt in allen bekannten Lebewesen vor und liefert die Energie, um Muskelkontraktion, Impulsausbreitung und chemische Synthese anzutreiben. Trotz der Schlüsselfunktion von ATP ist die Struktur des Enzyms, das ATP erzeugt, F1Fo-ATP Synthase, bei Säugetieren bislang unbekannt. Nun präsentieren Leonid Sazanov und seine Gruppe am Institute of Science and Technology Austria die erste vollständige Struktur von F1Fo-ATP Synthase bei Säugetieren. Diese Struktur klärt auch eine Debatte darüber, wie die sogenannte Permeabilitäts-Übergangspore (PTP) entsteht, eine Struktur, die an Zelltod, Krebs und Herzinfarkten beteiligt ist.

Reihen des ATP-Synthase Enzyms, wie sie sich auf den Furchen der Mitochondrienmembranen bilden würden. ATP, ADP und Lipide sind in leuchtenden Farben dargestellt.
Gergely Pinke / IST Austria
ATP Synthase wird auch als Komplex V der Atmungskette bezeichnet. Die Atmungskette ist eine Reihe von Proteinkomplexen in der Membran von Mitochondrien. Diese Kette erzeugt einen Protonengradienten, den die ATP-Synthase zur Herstellung von ATP nutzt. Sazanov löste bereits als Erster die Proteinstruktur des bakteriellen Komplex I, sowie die Proteinstruktur von Komplex I bei Säugetieren. In der neuen Studie wandten sich Sazanov und die Gruppenmitglieder Gergely Pink und Long Zhou dem Säugetierkomplex V zu, der letzten ungelösten Struktur in der Atmungskette von Säugetieren. „F1Fo-ATP Synthase ist eines der wichtigsten Enzyme der Erde. Es liefert Energie für die meisten Lebensformen, auch für uns Menschen. Aber bis jetzt wussten wir nicht genau, wie es funktioniert“, erklärt Sazanov.
Rotation trübt das Bild
Die Struktur der löslichen, pilzförmigen F1-Domäne ist bereits bekannt. Daher untersuchten Sazanov und sein Team insbesondere die Fo-Domäne, die in der Mitochondrien-Membran eingebettet ist. Hier werden Protonen an der Grenzfläche zwischen dem sogenannten c-Ring, einem Ring aus identischen Protein-Untereinheiten, und dem übrigen Fo transloziert. Die Protonen werden durch die Membran bewegt, indem jede c-Untereinheit auf der einen Seite der Membran ein Proton aufnimmt, sich mit dem Ring dreht und auf der anderen Seite das Proton wieder abgibt. Der c-Ring ist mit dem zentralen Schaft von F1 verbunden, seine Rotation erzeugt ATP innerhalb von F1. Um die Struktur der Fo-Domäne und des gesamten Komplexes zu lösen, untersuchten die Forscher das Enzym aus Schaf-Mitochondrien mittels Kryo-Elektronenmikroskopie. Hier wirft ATP-Synthase ein besonderes Problem auf: Weil es sich dreht, kann ATP-Synthase in drei Hauptpositionen stoppen, sowie in weiteren Unterpositionen. „Es ist schwierig, zwischen diesen Positionen zu unterscheiden und jeder Position, die ATP-Synthase einnehmen kann, eine Struktur zuzuweisen. Aber wir haben das rechnerisch geschafft und konnten so die erste vollständige Struktur des Enzyms bauen“, fügt Sazanov hinzu.
Position der Permeabilitäts-Übergangspore gefunden
In ihrer hochauflösenden Struktur von Fo fanden die Forscher, dass zwei Lipide den c-Ring zustöpseln, von jeder Membranseite ein Lipid. Während das obere (F1 zugewandte) Lipid gemeinsam mit dem Schaft rotiert, rotiert das untere Lipid nicht, da es wahrscheinlich über einen „Hakenapparat“ mit der Fo-Domäne verbunden ist.
Diese neu entdeckte Struktur wirft Licht auf eine Kontroverse in der Biologie: wie und wo sich die Permeabilitäts-Übergangspore öffnet. Diese Pore steht in Verbindung mit Zelltod und öffnet sich beispielweise während Schlaganfällen oder Herzinfarkten. Bisher war bekannt, dass sich die Pore als Antwort auf hohe Kalziumkonzentrationen in Mitochondrien bildet. Aber die genaue Lage der Pore blieb unbekannt. Jetzt, mit der vollständig gelösten Struktur von F1Fo, können Sazanov und seine Gruppe beschreiben, wie sich die Pore in der F1Fo-ATP Synthase bildet: Wenn Kalzium an die F1-Domäne bindet, ändert sich die Konformation der Domäne. Der Komplex muss sich dieser Veränderung anpassen und zieht dabei am „Hakenapparat“. Dieser Apparat wiederum zieht den Lipid-Stöpsel aus der Unterseite von Fo, was die Porenöffnung einleitet. „Wenn die Pore über einen längeren Zeitraum offen ist, wird der c-Ring destabilisiert und die Porenbildung wird irreversibel“, erklärt Sazanov. „Dieses Model stimmt mit allen verfügbaren Daten von Mutanten überein. Um völlig sicher zu sein, dass sich die Permeabilitäts-Übergangspore auf diese Weise bildet, müsste man die Struktur der ATP-Synthase während der kalziuminduzierten Übergänge lösen, was wir jetzt tun.“