Beweglicher als gedacht
Neue Erkenntnisse über das Spikeprotein von SARS-CoV-2
Im Kampf gegen das Coronavirus SARS-CoV-2 wird intensiv an Impfstoffen und neuen Therapien geforscht. Für das Eindringen in die Zellen benötigt das Virus das Spikeprotein auf seiner Virusoberfläche. Wissenschaftler des Paul-Ehrlich-Instituts haben im Verbund mit Forschungsgruppen in Deutschland (EMBL in Heidelberg, MPI für Biophysik in Frankfurt) mit hochauflösenden bildgebenden und computergestützten Verfahren das Spikeprotein in seiner natürlichen Umgebung analysiert. Dabei haben sie eine nicht vermutete Bewegungsfreiheit der auf der Virusoberfläche befindlichen Spikes entdeckt.
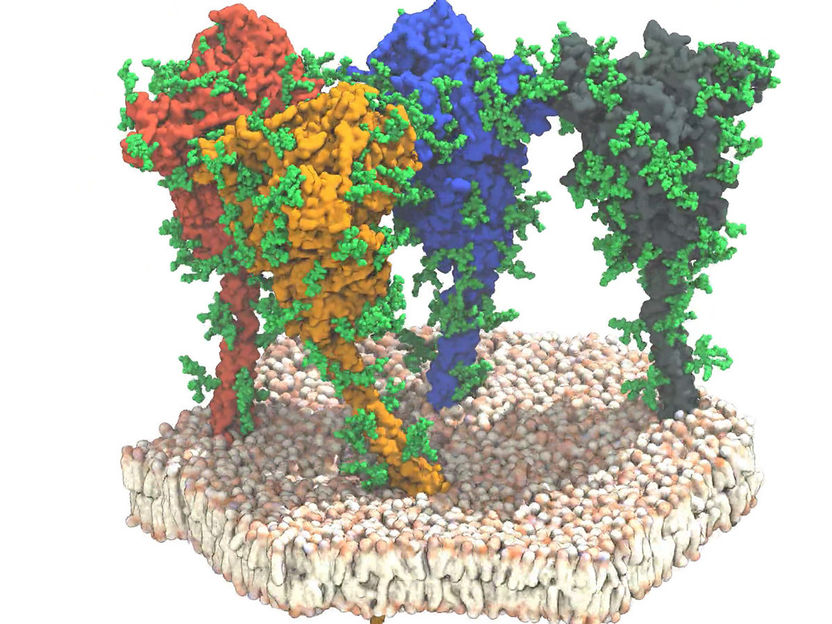
Simulation von vier Spike-Proteinen (rot, orange, blau und grau) des SARS-CoV-2-Virus. Die Proteine und Lipide sind in Oberflächendarstellung dargestellt. Die schützenden Glykanketten sind grün dargestellt.
MPI for Biophysics, Frankfurt/Main
Das Coronavirus SARS-CoV-2 benötigt die Spikeproteine (S) auf seiner Oberfläche, um an spezifische Rezeptoren auf der Oberfläche menschlicher Zellen zu binden und über diesen Weg die Zellen zu infizieren. Diese stachelförmigen Strukturen stehen im Mittelpunkt der Entwicklung von Impfstoffen, denn sie sollen als Antigen eine vor COVID-19 schützende Immunantwort beim Menschen induzieren. Intensiv untersuchen Forschende das Virus und insbesondere dessen Oberflächenstruktur, um Erkenntnisse sowohl für die Impfstoffe als auch für die Entwicklung wirksamer Therapeutika zur Behandlung infizierter Patientinnen und Patienten zu gewinnen. Von großer Bedeutung ist hierbei die Kenntnis der räumlichen Strukturen, die für Prozesse wie beispielsweise das Eindringen in die Zielzellen bedeutsam sind.
Die Kombination modernster Technologien der Kryo-Elektronentomografie, Subtomogramm-Mittelung und Molekulardynamik-Simulationen ermöglichen die strukturelle Analyse von Molekülstrukturen in natürlicher Umgebung und mit nahezu atomarer Auflösung. Forscher des Paul-Ehrlich-Instituts um Prof. Jacomine Krijnse Locker, Leiterin der Loewe-Forschungsgruppe „Elektronenmikroskopie von Pathogenen“ haben gemeinsam mit dem von Priv.-Doz. Michael Mühlebach geleiteten Fachgebiet im Verbund mit Forschenden des Europäischen Laboratoriums für Molekularbiologie (EMBL, European Molecular Biology Laboratory), des Max-Planck-Instituts für Biophysik sowie dem Institut für Biophysik der Goethe-Universität Frankfurt/Main mit bildgebenden Verfahren und Simulationsmodellen das Spikeprotein in seiner natürlichen Umgebung analysiert. Hierfür nutzten sie SARS-CoV-2-Partikel, die aus dem Überstand infizierter Zellen gewonnen wurden. Mithilfe modernster Elektronenmikroskopie am EMBL wurden 266 Kryo-Tomogramme von etwa 1000 verschiedenen Viren erstellt, die jeweils durchschnittlich 40 Spikes auf ihrer Oberfläche trugen. Durch Subtomogramm-Mittelung und Bildverarbeitung konnten von insgesamt 40.000 Spikes wichtige Strukturinformationen gewonnen werden.
Ein für die Impfstoffentwicklung erfreuliches Ergebnis: Der obere Kugel- bzw. V-förmige Teil des Spikes weist unter natürlichen Bedingungen eine Struktur auf, die von rekombinanten Proteinen, die für die Impfstoffentwicklung genutzt werden, gut wiedergegeben wird. Befunde über den Stiel, mit dem der globuläre Teil des Spikes auf der Virusoberfläche fixiert ist, waren jedoch neu.
Über diese Struktur war bisher wenig bekannt. Jetzt entdeckten die Wissenschaftler, dass der Stiel äußerst flexibel ist. In den Aufnahmen stand er selten gerade auf der Membran, sondern war in alle Richtungen geneigt.
Das Team identifizierte vier verschiedene Domänen (Abschnitte) im Stiel, die sie als „Hüft-“, „Knie“-, „Knöchel“-Domäne und schließlich als in die Membran eingebettete „Fuß“-Domäne bezeichneten. Durch Kombination von Molekulardynamik-Simulationen und Kryo-Tomographie wiesen die Forschenden nach, dass diese Domänen Biegebewegungen ausführen können. Die Daten zeigen, dass der globuläre Anteil des Spikes, der den Rezeptorbindungsbereich und die für die Fusion mit der Zielzelle erforderlichen Bestandteile enthält, mit einem flexiblen Stiel verbunden ist. „Wie ein Ballon an einer Schnur scheinen sich die Spikes auf der Oberfläche des Virus zu bewegen und so den Rezeptor für das Andocken an der Zielzelle suchen zu können“, beschreibt Prof. Jacomine Krijnse Locker die Ergebnisse. Die Analysen zeigten schließlich, dass der Stiel mit vielen Glykanketten versehen ist. Diese könnte dem Stiel eine Art schützenden Mantel verleihen und ihn so vor neutralisierenden Antikörpern abschirmen. Dies kann jetzt in weiteren Experimenten geklärt werden und wird zum Verständnis der immunologischen Eigenschaften des Spikeproteins auf dem Weg zu wirksamen Impfstoffen beitragen!
Originalveröffentlichung
Turoňová* B, Sikora* M, Schürmann* C, Hagen WJH, Welsch S, Blanc FEC, Sören von Bülow S, Gecht M, Bagola K, Hörner C, v Zandbergen G, Mosalaganti S, Schwarz A, Covino R, Mühlebach MD, Hummer G, Krijnse Locker J, Beck M; "In situ structural analysis of SARS-CoV-2 spike reveals flexibility mediated by three hinges"; Science; 2020 (*contributed in equal parts)
























































