Spezifisches Steuerungsmolekül in Blutplättchen identifiziert
Ansatzpunkt für die Medikamentenentwicklung gegen Thrombosen, Herzinfarkte und Schlaganfälle
Das bislang weitgehend unbekannte Molekül namens bridging integrator 2 (BIN2) spielt bei der Aktivierung der Blutplättchen eine zentrale Rolle, wie Würzburger Forscher jetzt in einem Gemeinschaftsprojekt des DFG-Sonderforschungsbereichs/Transregio 240 zeigen konnten. Diese Erkenntnis liefert Hinweise auf Ansatzpunkte für die Medikamentenentwicklung gegen Thrombosen, Herzinfarkte und Schlaganfälle und wurde in der Fachzeitschrift The Journal of Clinical Investigation veröffentlicht.
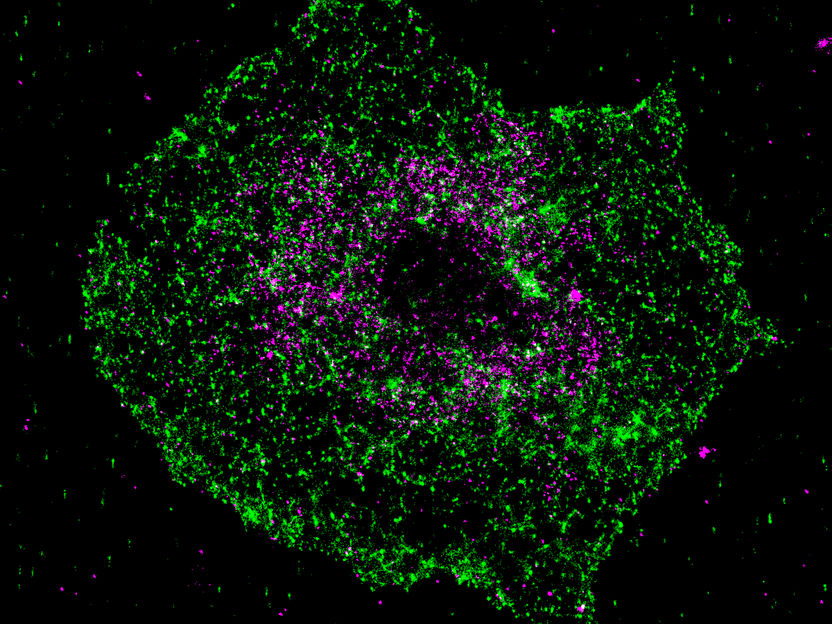
Bild: Aufklärung der Kolokalisierung von BIN2 (grün) und STIM1 (magenta) mit Hilfe von superhochauflösender Fluoreszenzmikroskopie (dSTORM) im aktivierten Blutplättchen.
AG Nieswandt, Rudolf Virchow Zentrum
Kalzium ist in fast allen Zellen ein wichtiges Signalmolekül. Auch Blutplättchen, in der Fachsprache Thrombozyten genannt, werden durch Kalzium aktiviert und tragen dann zur Blutstillung und zum Wundverschluss bei. Allerdings kann eine fehlgeleitete Aktivierung der Blutplättchen durch unkontrollierte Kalzium-Signale auch zu akut lebensbedrohlichen Ereignissen wie Thrombosen, Herzinfarkten und Schlaganfällen führen, sowie Entzündungsreaktionen in den Blutgefäßen auslösen.
Mitspieler der Thrombozyten-Aktivierung identifiziert
Bisher war vor allem das Molekül stromal interaction molecule 1 (STIM1) als essentieller Baustein bei der Regelung von Kalziumsignalen bekannt. Allerdings hat es diese Funktion in fast allen Zellen des Körpers inne und ein Verlust von STIM1 hat daher starke Auswirkungen wie die Schwächung des Immunsystems. Aus diesem Grund eignet es sich nicht als Zielstruktur für die Entwicklung von Medikamenten.
„In unserer Studie konnten wir das bisher recht unbekannte Molekül BIN2 als neuen Interaktionspartner von STIM1 in Blutplättchen identifizieren und darüber hinaus zeigen, dass BIN2 auch mit einem weiteren Baustein der Kalzium-Maschinerie interagiert“, erklärt Prof. Dr. Bernhard Nieswandt vom Rudolf-Virchow-Zentrum der Universität Würzburg. Das Besondere an BIN2 ist, dass es sehr spezifisch in Blutplättchen vorkommt und nicht, wie STIM1, in vielen anderen Zellen. „Dadurch können wir die Thrombozyten zielgenau ansteuern, ohne die Funktionen in anderen Zellen zu stören“, ergänzt Doktorandin Julia Volz, die entscheidend an der Studie mitwirkte.
Die Entdeckung wurde durch die Zusammenarbeit mehrerer Forschungsgruppen aus dem Sonderforschungsbereich Transregio 240, der Universität Würzburg und des Uniklinikums Würzburg und deren breites Methodenspektrum möglich. „Durch Superhochauflösende Fluoreszenzmikroskopie konnten wir nachweisen, dass die Moleküle STIM1 und BIN2 im Plättchen in gewissen Abständen kolokalisieren und damit die biochemischen Daten untermauern“, erklärt Charly Kusch, der ebenfalls als Doktorand maßgeblich an der Arbeit beteiligt war.
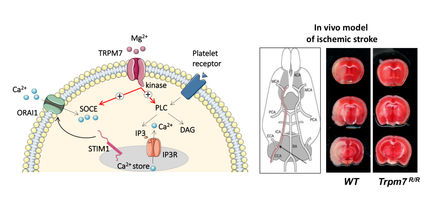
Mäuse ohne BIN2 sind vor schweren Verläufen des Schlaganfalls geschütz
Mäuse die kein BIN2 haben weisen stark reduzierte Kalziumsignale in den Thrombozyten auf. Dadurch kommt es in ihren Blutgefäßen nach Beschädigung der Gefäßwand zu kleineren Blutgerinnseln, die Tiere sind teilweise geschützt vor arterieller Thrombose und Schlaganfälle haben einen milderen Verlauf. Das zeigt, dass Moleküle wie BIN2 ein Ansatzpunkt für die Medikamentenentwicklung gegen Thrombosen, Herzinfarkte und Schlaganfälle sein könnten. Dazu müssen nun die genauen molekularen Mechanismen und weitere Interaktionspartner untersucht werden.