Brüche im Erbgut
Neues Verfahren soll die Diagnose von Erbkrankheiten verbessern
Brüche und Umlagerungen im Erbgut können zu schweren Erkrankungen führen, selbst wenn die Gene dabei intakt bleiben. Eine zuverlässige und genaue Diagnose solcher Defekte verspricht Hi-C, eine Methode zur Analyse der dreidimensionalen Struktur von Chromosomen, die derzeit in der Klinik noch nicht genutzt wird. Ein Forschungsteam um die Humangenetiker Malte Spielmann und Stefan Mundlos vom Max-Planck-Institut für molekulare Genetik und der Charité – Universitätsmedizin Berlin hat das Hi-C-Verfahren zur Untersuchung von Patienten mit genetischen Entwicklungsstörungen eingesetzt.

Mit Fluoreszenzfarbstoffen gefärbte Chromosomen unter dem Mikroskop. Die DNA ist blau angefärbt, zusätzlich wurde die zu untersuchende Region mithilfe einer Sonde pink markiert. Diese Region tritt in einer Kopie eines Chromosoms zweimal auf, in der zweiten jedoch nicht. Der Abschnitt ist verdoppelt und an anderer Stelle desselben Chromosoms wieder eingefügt. Dies kann zu einer Erkrankung führen.
© MPIMG/ Uirá Souto Melo
Schon die Veränderung eines einzigen Bausteins im Genom kann Krankheiten auslösen. Aber auch das Entfernen großer Abschnitte oder ihre Verschiebung an neue Positionen kann dramatische Folgen haben. Zellen mit solchen Defekten sind oftmals nicht überlebensfähig, weil durch den Verlust oder die Veränderung von Genen wichtige Funktionen nicht mehr wahrgenommen werden können.
Selbst wenn beim Bruch eines Chromosoms alle Gene intakt bleiben, können ernsthafte Probleme entstehen: Steuerelemente in der DNA können an die falsche Stelle gelangen und dort Gene zur falschen Zeit oder am falschen Ort aktivieren. Dies kann Krebs, neurodegenerativen Erkrankungen oder Entwicklungsstörungen verursachen.
Schlaufen im Erbgut
Trotz großer Fortschritte im Bereich der genetischen Diagnostik bleibt die Identifizierung der genetischen Ursachen erblicher Erkrankungen ausgesprochen schwierig. „In über der Hälfte der Fälle gelingt es trotz umfangreicher Analyse nicht, die ursächliche Mutation zu finden“, sagt Stefan Mundlos vom Max-Planck-Institut für molekulare Genetik und der Charité – Universitätsmedizin Berlin. „Selbst eine Sequenzierung des gesamten Genoms hilft den Betroffenen häufig nicht weiter.“
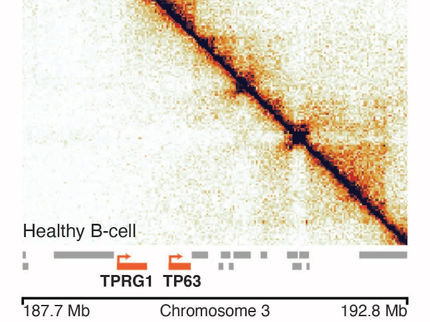
Wie das Team um die Humangenetiker Stefan Mundlos und Malte Spielmann schildert, könnte ein Verfahren aus der Grundlagenforschung die klinische Diagnostik künftig entscheidend verbessern. Die Forscher untersuchten eine Gruppe von Betroffenen, deren Erkrankungen vermutlich durch Umlagerungen im Erbgut verursacht worden waren. Sie nutzten dafür ein Verfahren namens „Hi-C“ (kurz für "high-throughput chromosome conformation capture": Konformationserfassung von Chromosomen im Hochdurchsatz), mit dem dargestellt werden kann, welche Abschnitte des Genoms sich im Zellkern in räumlicher Nähe zueinander befinden. Chromosomale Umlagerungen verändern diese räumliche Anordnung, dies wird in der Analyse sichtbar.
Das Team untersuchte Blut-, Haut- und Fruchtwasserproben von insgesamt neun Betroffenen, bei denen zwar Chromosomenbrüche nachgewiesen, aber kein bekanntes Gen verändert war. „Wir wollten wissen, ob wir mit Hi-C den klinischen Befund nachvollziehen oder die Diagnose sogar verbessern konnten“, sagt Malte Spielmann, der die Studie gemeinsam mit Mundlos leitete. „Tatsächlich war das Ergebnis viel komplexer als erwartet.“
Hi-C entwirrt geordnet verknäulte DNA
Die klassische Analyse von Chromosomendefekten erfolgt durch ein Karyogramm – dabei werden angefärbte Chromosomen durch ein Mikroskop betrachtet. Eine weitere Methode, die vergleichende Genomhybridisierung, arbeitet mit fluoreszenzmarkierten DNA-Abschnitten. Sie zeigt an, wo das Erbgut Lücken oder Dopplungen aufweist. Dennoch sind beide Verfahren verhältnismäßig ungenau. „Es ist nur erkennbar, dass etwas nicht stimmt. Worum es sich jedoch genau handelt, lässt sich schwer beurteilen“, sagt Uirá Souto Melo, der gemeinsam mit Rocio Acuna-Hidalgo und Robert Schöpflin Erstautor dieser Arbeit ist.
Es käme auch darauf an, welche Abschnitte des Erbgutfadens sich untereinander berühren, erklärt der Wissenschaftler: „Die DNA ist nicht einfach zufällig im Zellkern verteilt.“ Tatsächlich ist die DNA räumlich im Zellkern organisiert und weist abgegrenzte Segmente und mehrere räumliche Organisationsebenen auf. Bislang können nur mit dem Hi-C-Verfahren die Kontakthäufigkeiten des Erbgutfadens im dreidimensionalen Raum genomweit kartiert werden.
Schlaufen und Dreiecke
Melo untersuchte die Patientenzellen mithilfe der Hi-C-Methode. Zunächst wurde die DNA so behandelt, dass sich Segmente, die sich im Zellkern berühren, permanent aneinanderbanden. Anschließend wurde das Erbgut in kleine Stücke zerteilt und diese zum Schluss sequenziert. DNA-Abschnitte, die im Zellkern in räumlicher Nähe zueinander lagen, konnten so gemeinsam sequenziert werden.
Nach der bioinformatischen Auswertung wurde die Häufigkeit der Kontakte in einer sogenannten Heatmap dargestellt, in der die Farbintensität der einzelnen Punkte zeigt, wie häufig in der Probe ein Kontakt zwischen zwei DNA-Abschnitten beobachtet wurde. „Für Bereiche des Genoms, in denen besonders intensive Kontakte bestehen und die zu einem gewissen Grad von den benachbarten Regionen abgegrenzt sind, ergeben sich charakteristische dreieckige Formen in der Heatmap“, erklärt Bioinformatiker Robert Schöpflin. „Solche Regionen stellen eine Art große Schlaufen im Erbgut dar, in denen Steuerelemente und Gene gemeinsam organisiert sind." Die Regionen werden als "topologisch assoziierte Domänen" (TADs) bezeichnet; sie stellen Regionen mit hoher Interaktion im dreidimensionalen Raum dar.
Wichtige Grenzen
Wenn diese Schlaufenbildung durch einen Bruch im Erbgut gestört wird, können die Folgen gravierend sein. „Die Domänen verhalten sich wie ein Behälter mit gläsernen Kammern mit Öl, Wasser und Salz“, sagt Melo. „Nehme ich das Glas zwischen den Kammern heraus, vermischt sich der Inhalt und die Zusammensetzung verändert sich natürlich.“
In ähnlicher Weise kann sich die Reichweite von genetischen Steuerungsfaktoren verändern, wenn die Grenzen zwischen den TADs verschwinden. Ohne die limitierenden Grenzen können einzelne Faktoren Gene in einer DNA-Schlaufe steuern, für die sie gar nicht zuständig sind - und die Regulationsmechanismen in der Zelle brechen zusammen. „Wenn die Grenze zwischen zwei Domänen entfällt oder deren Inhalt vertauscht wird, kann ein Gen, das normalerweise für die Entwicklung der Gliedmaßen verantwortlich ist, zum Beispiel im Gehirn aktiviert werden und dort Fehlentwicklungen verursachen", sagt der Wissenschaftler.
In den jetzt untersuchten klinischen Proben konnte das Team nicht nur die bestehenden Befunde bestätigen und präzisieren, welchen Effekt falsch zusammengesetzte TAD-Genomschlaufen hatten. Die Forscher könnten darüber hinaus noch weitere Bruchstellen nachweisen, die mit den klassischen diagnostischen Methoden nicht sichtbar waren.
Der Weg in die Klinik
„Schon morgen Hi-C in der Klinik anzuwenden, wäre natürlich ein Traum“, sagt Melo. „Derzeit ist das aber leider noch nicht möglich.“ Noch wären die Kosten zu hoch und das Verfahren zu kompliziert, um Patienten routinemäßig mit diesem Verfahren zu testen. Das Team ist jedoch davon überzeugt, dass die noch jungen Methode viel Raum für Weiterentwicklungen bietet. So könnten Laborarbeit automatisiert und Algorithmen weiter verbessert werden und auch bei der Sequenzierung gäbe es Einsparpotenial, sagt der Forscher. „Wichtig ist nun, dass wir mit den Kolleginnen und Kollegen aus der Humangenetik und Medizin auf der ganzen Welt ins Gespräch kommen, um aus einer Labormethode ein echtes diagnostisches Verfahren entwickeln zu können.“
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Diagnostik
Die Diagnostik ist das Herzstück der modernen Medizin und bildet in der Biotech- und Pharmabranche eine entscheidende Schnittstelle zwischen Forschung und Patientenversorgung. Sie ermöglicht nicht nur die frühzeitige Erkennung und Überwachung von Krankheiten, sondern spielt auch eine zentrale Rolle bei der individualisierten Medizin, indem sie gezielte Therapien basierend auf der genetischen und molekularen Signatur eines Individuums ermöglicht.

Themenwelt Diagnostik
Die Diagnostik ist das Herzstück der modernen Medizin und bildet in der Biotech- und Pharmabranche eine entscheidende Schnittstelle zwischen Forschung und Patientenversorgung. Sie ermöglicht nicht nur die frühzeitige Erkennung und Überwachung von Krankheiten, sondern spielt auch eine zentrale Rolle bei der individualisierten Medizin, indem sie gezielte Therapien basierend auf der genetischen und molekularen Signatur eines Individuums ermöglicht.