Ein chemischer Maßanzug für das Alzheimer-Medikament
Forschungsteam entwickelt neue Hemmstoffe für Enzyme
Mit über 1,2 Millionen Betroffenen allein in Deutschland und weltweit über 50 Millionen Erkrankten stellt die Alzheimer-Krankheit, auch „Alzheimer Demenz“ genannt, eine der größten medizinischen und gesellschaftlichen Herausforderungen unserer Zeit dar. Durch krankhafte Veränderungen im Gehirn werden Patienten mit fortschreitender Krankheit immer vergesslicher und orientierungsloser, im schlimmsten Fall werden sogar nahestehende Verwandte nicht mehr erkannt. Selbst einfache Tätigkeiten im Haushalt können nicht mehr selbstständig durchgeführt werden und erfordern daher die Pflege Betroffener. Trotz intensiver Forschung gilt die Alzheimer-Krankheit bis heute als unheilbar. Forscher der Universität Göttingen sowie dem Fraunhofer-Institut für Zelltherapie und Immunologie Leipzig-Halle haben einen vielversprechenden Ansatz beschrieben, die Alzheimer-Krankheit zu behandeln. Die Ergebnisse sind in der Fachzeitschrift Biochemistry erschienen.
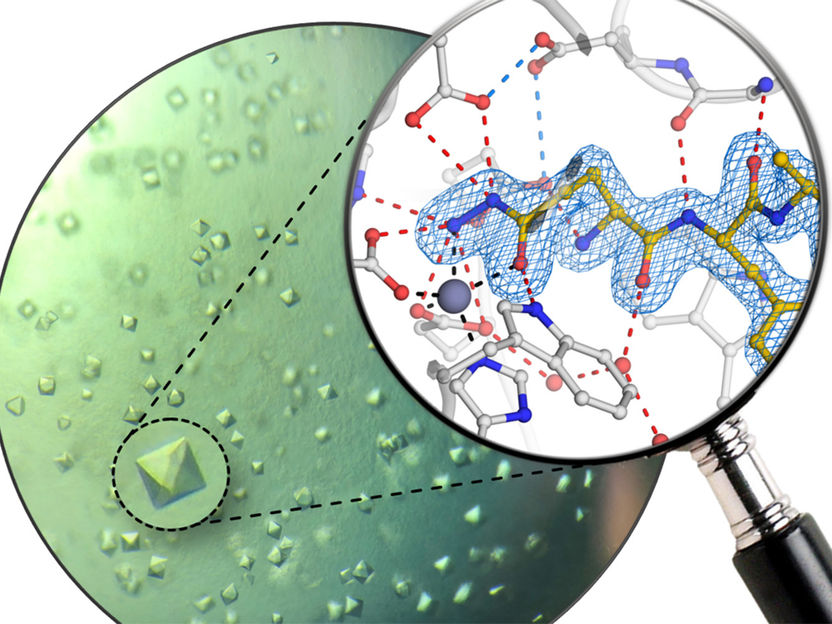
Proteinkristalle des humanen Enzyms Glutaminylzyklase und atomare Struktur des neuen Inhibitors.
Lisa-Marie Funk
Für die Studie arbeitete Prof. Dr. Kai Tittmann vom Göttinger Zentrum für Molekulare Biowissenschaften gemeinsam mit Forschern aus der Fakultät für Chemie der Universität Göttingen sowie dem Team um Prof. Dr. Hans-Ulrich Demuth vom Fraunhofer IZI in Halle zusammen. Bereits vor einigen Jahren hatte das Team aus Halle die Entdeckung gemacht, dass ein bestimmtes Enzym des Hormonstoffwechsels aus dem menschlichen Gehirn neben seiner eigentlichen biologischen Funktion, der Hormonreifung, eine kritische, pathophysiologische Rolle bei der Entstehung der Alzheimer-Krankheit spielt. Erste Inhibitoren dieses Enzyms, die bestimmte Stoffwechselvorgänge hemmen, lieferten bereits vielversprechende Ergebnisse.
Um diesen Wirkstoffen einen chemischen Maßanzug zu verpassen, untersuchte das Forschungsteam den Reaktionsmechanismus des Enzyms durch Proteinkristallographie. „So konnten wir erstmalig ,Schnappschüsse‘ des arbeitenden Enzyms erhalten“, sagt Hauptautor Tittmann. Dadurch war es möglich, neuartige Inhibitoren zu bauen, deren Designprinzip der natürlichen Reaktion nachempfunden ist. Diese führen daher zu einer hochselektiven Bindung ohne die Gefahr gefährlicher Nebenwirkungen. Den Wissenschaftlern gelang es zudem, mit dem neuen Wirkstoff eine atomare Struktur des menschlichen Enzyms zu lösen. Dies bildet eine wichtige Grundlage für den weiteren Ausbau der Inhibitoren. „Wir sind zuversichtlich, dass unsere Ergebnisse zur Entwicklung einer neuen, hochselektiven Generation von Alzheimer-Medikamenten führen wird“, erklärt Demuth.
Originalveröffentlichung
Meistgelesene News
Originalveröffentlichung
Oliver Kupski et al.; "Hydrazides Are Potent Transition-State Analogues for Glutaminyl Cyclase Implicated in the Pathogenesis of Alzheimer’s Disease"; Biochemistry; 2020
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.



















































