Grundlagen der Funktionen von Glutaredoxin-Proteinen im Eisenstoffwechsel und der Signalübertragung aufgeklärt
Beim Protein-Engineering wurden die entscheidenden Loop-Strukturen der beiden Protein-Klassen gegeneinander ausgetauscht
Die Proteine der Glutaredoxin-Familie sind lebenswichtig. Es gibt von ihnen zwei Klassen, die zwar sehr ähnliche Strukturen aufweisen, aber dennoch unterschiedliche Funktionen haben. Ein internationales Forschungskonsortium unter Leitung von Christopher Horst Lillig vom Institut für Medizinische Biochemie und Molekularbiologie der Universitätsmedizin Greifswald konnte die Unterschiede in der Funktion der beiden Klassen nun auf eine Loop-Struktur zurückführen.
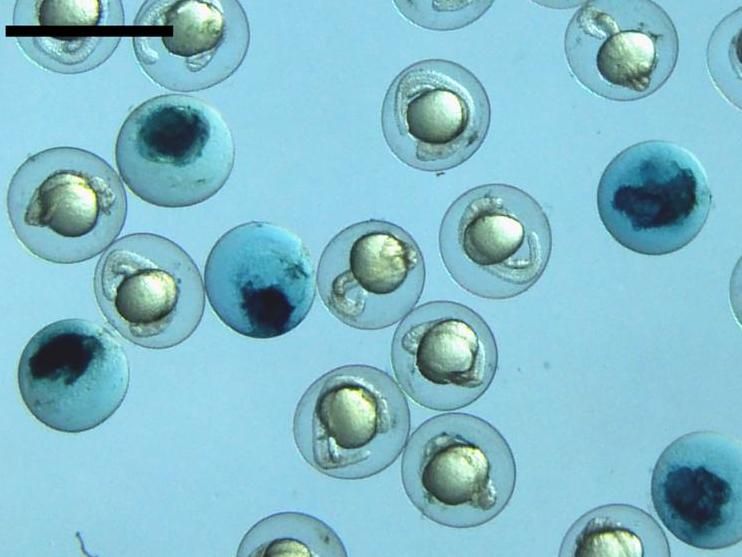
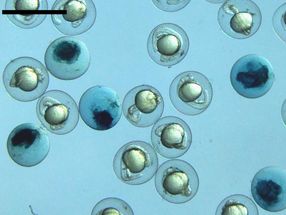
Das Bild zeigt Eier von Zebrafischen während der Entwicklung. Ein Verlust des Glutaredoxin 5 führt zum Absterben während der Entwicklung (dunkle Eier). Dieser Effekt kann nur durch Glutaredoxine kompensiert werden, die im Eisenstoffwechsel aktiv sind.
Carsten Berndt
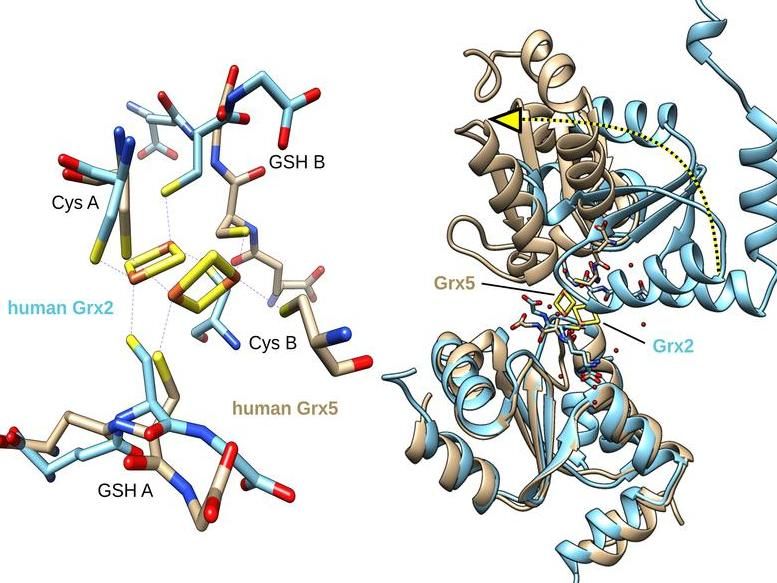
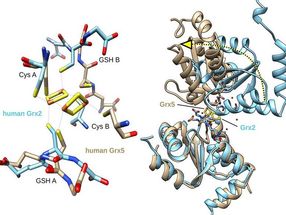
Bindung der Kofaktoren Glutathion (GSH) in den beiden Klassen der Glutaredoxine (links). Diese unterschiedliche Bindung hat eine große Änderung der 3-dimensionalen Struktur zur Folge (rechts), welche die unterschiedlichen Funktionen der Protein
Christopher Horst Lillig
Die Erkenntnisse sind wichtig, um den Energiestoffwechsel in Zellen sowie Erkrankungen wie Krebs, multiple Sklerose oder Morbus Parkinson besser zu verstehen. Die Ergebnisse wurde in der Zeitschrift Nature Communications veröffentlicht.
Die zwei Protein-Klassen der Glutaredoxin-Familie kommen in nahezu allen Lebewesen vor. Beide Klassen sind wichtig für den Energiestoffwechsel in Zellen. Die Proteine der ersten Klasse (CGFS-Typ) sind unentbehrlich im zellulären Eisenstoffwechsel. Ist diese Klasse nicht mehr voll funktionsfähig, so führt dies zu einem Verlust wichtigster Eisen-Kofaktoren wie beispielsweise das Hämoglobin. Hämoglobin wird für den Sauerstofftransport gebraucht. Die Proteine der zweiten Klasse (CxxC/S-Typ) sind Oxidoreduktasen. Sie übertragen Elektronen und sind unter anderem unentbehrlich für die Gehirnentwicklung. Funktion und Aktivität der beiden Klassen ist also sehr unterschiedlich, und das obwohl beide Klassen eine sehr ähnliche räumliche Struktur haben und auch beide den Kofaktor Glutathion binden können.
„Beide Proteine beeinflussen das Zellenwachstum. Wenn wir die Funktion der beiden Klassen besser verstehen, dann ergeben sich daraus neue Ansätze, um beispielsweise das Wachstum von Krebszellen einzudämmen und so krebskranken Menschen zu helfen. Wollen wir auf der anderen Seite neurodegenerative Erkrankungen wie beispielsweise multiple Sklerose oder Morbus Parkinson in ihrem Verlauf abschwächen, dann können wir die Erkenntnisse dafür nutzen, das Wachstum von Nervenzellen anzuregen. Das entscheidende Schlüsselelement dafür ist eine Loop-Struktur vor dem aktiven Zentrum der beiden Protein-Klassen,“ berichtet Christopher Horst Lillig vom Institut für Medizinische Biochemie und Molekularbiologie der Universitätsmedizin Greifswald.
Diese Loop- oder auch Schleifen-Struktur, die sich am aktiven Zentrum der beiden Protein-Klassen befindet, hat das internationale Forschungsteam nun durch gezieltes Protein-Engineering zweier humaner Vertreter der Glutaredoxine untersucht. Beim Protein-Engineering wurden die entscheidenden Loop-Strukturen der beiden Protein-Klassen gegeneinander ausgetauscht. Dadurch haben sich auch die Funktionen und Aktivitäten der beiden Proteine umgekehrt. Die identifizierten Strukturen sind dafür verantwortlich, dass die beiden Protein-Klassen unterschiedlich mit ihrem gemeinsamen Kofaktor Glutathion wechselwirken. Das wiederum bestimmt deren grundsätzlich unterschiedlichen Funktionen. Die gewonnenen Erkenntnisse helfen, Prozesse in Zellen sowie deren Fehlfunktionen besser zu verstehen.
Originalveröffentlichung
Trnka D*., Engelke A.*, Gellert M.*, Moseler A., Hossain M.F., Lindenberg T., Pedroletti L., Odermatt B., de Souza J., Bronowska A., Dick T., Mühlenhoff U., Meyer A., Berndt C., Lillig C.H. (2020): „Molecular basis for the distinct functions of redox-active and FeS-transfering glutaredoxins,“ in: Nature Communications.