Tumor-Therapie im Spiegel
Checkpoint-Blockade durch D-Peptid für Immuntherapie gegen Krebs
Eigentlich sollte unser Immunsystem Tumorzellen erkennen und töten. Viele Tumore tricksen das Immunsystem aber aus. Beispielsweise bringen sie sogenannte Immun-Checkpoints von T-Zellen dazu, Immunreaktionen herunterzufahren. In der Zeitschrift Angewandte Chemie stellen Wissenschaftler jetzt einen neuen Ansatz für eine immunologische Tumortherapie vor, der auf der spezifischen Blockade eines Immun-Checkpoints durch ein stabiles „spiegelbildliches“ Peptid beruht.
Viele Tumore tricksen das Immunsystem aus, indem sie z.B. sogenannte Immun-Checkpoints von T-Zellen dazu bringen, die Immunreaktionen herunterzufahren. Ein stabiles „spiegelbildliches“ Peptid soll einen Immun-Checkpoint spezifisch blockieren.
(c) Wiley-VCH
T-Lymphozyten tragen verschiedene Immun-Checkpoints auf ihrer Oberfläche: solche, die das Immunsystem ankurbeln, und solche, die Immunreaktionen unterdrücken, wenn sie zu ihnen passende Liganden auf der Oberfläche der „abgecheckten“ Zellen „entdecken“. Programmed Cell Death Protein 1 (PD-1) ist ein solcher Immun-Checkpoint. Bindet der Liganden PD-L1 an PD-1, wird die Immunantwort gehemmt, um zu verhindern, dass gesunde, körpereigene Zellen angegriffen werden. Leider „tarnen“ sich viele Tumore mit einer besonders hohen Zahl an PD-L1 und werden dadurch verschont. Eine Blockade der Wechselwirkung zwischen PD-1 und PD-L1 kann die Krebs-Immunität in der Mikroumgebung von Tumoren normalisieren. Bisherige therapeutische Ansätze brachten jedoch nicht den gewünschten Erfolg und oft entwickelte der behandelte Tumor eine Resistenz.
Ein alternatives Angriffsziel könnte der neu entdeckte Immun-Checkpoint TIGIT sein, der auf das Molekül PVR mit einem immunsuppressiven Signal reagiert. Die Forscher um Yanfeng Gao und Lei Liu von der Zhengzhou-Universität, der Tsinghua-Universität in Peking und der Sun-Yat-sen-Universität in Shenzhen stellten anhand von RNA-Expressions-Daten aus dem Cancer Genome Atlas sowie Datensätzen aus Gene Expression Omnibus fest, dass TIGIT in vielen Tumoren häufiger vorkommt als PD-1, auch in solchen mit einer Resistenz gegenüber einer anti-PD-1-Therapie.
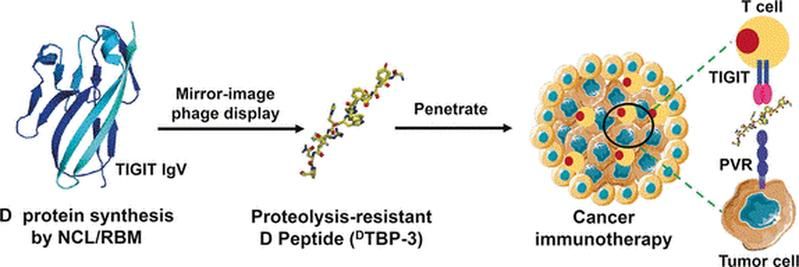
Als Wirkstoff wollten sie Peptide einsetzen, da diese bei gleich hoher Affinität und Spezifizität wie Antikörper tiefer ins Gewebe eindringen, wesentlich weniger unerwünschte immunologische Nebenwirkungen auslösen und leichter herstellbar sind. Der Nachteil: Im Körper werden sie sehr rasch von Proteasen abgebaut. Die Forscher setzten daher auf Peptid-„Spiegelbilder“, die gegenüber Proteasen stabil sind. Aminosäuren können in der natürlichen L- oder einer dazu spiegelbildlichen, künstlichen D-Form vorliegen. Aus D-Aminosäuren aufgebaute D-Peptide sind wesentlich langlebiger als L-Peptide.
Um ein geeignetes Peptid zu finden, wählten die Forscher die „Spiegelbild-Phagendisplay-Technik“. Beim Phagendisplay werden sehr großen Zahlen mehrerer biotechnologisch hergestellter Peptide auf der Oberfläche von Phagen (Viren, die Bakterien befallen) präsentiert und solche selektiert, die an das gewählte Zielmolekül binden. Die Treffer werden in Bakterien vermehrt und durchlaufen weitere Selektionsrunden, bis am Ende besonders stark bindende Peptide übrig sind. Beim Spiegelbild-Phagendisplay werden zunächst L-Peptide präsentiert, aber solche ausgewählt, die an das Spiegelbild des Zielmoleküls binden. Dafür synthetisierten die Forscher ein TIGIT-Teilstück in der D-Fassung. Von dem am stärksten bindenden L-Peptid stellten sie dann die spiegelbildliche D-Version her, die nun ihrerseits das natürliche TIGIT/PVR bindet.
Das so entwickelte D-Peptid DTBP-3 blockiert effektiv die Wechselwirkung von TIGIT mit PVR, ist Protease-stabil und hemmt Wachstum und Metastasierung anti-PD-1-resistenter Tumor-Modelle.