Neue Methode zeigt, wie das Parkinson-Protein die Zellmembranen schädigt
Methode ermöglicht es, winzige Mengen biologischer Moleküle ohne Verwendung von Fluoreszenzmarkern zu untersuchen
Bei Parkinson-Patienten finden sich im Gehirn Klumpen von α-Synuclein (Alpha-Synuclein), die manchmal als "Parkinson-Protein" bezeichnet werden. Diese zerstören Zellmembranen, was schließlich zum Zelltod führt. Eine neue Methode, die an der Chalmers University of Technology, Schweden, entwickelt wurde, zeigt nun, wie die Zusammensetzung der Zellmembranen ein entscheidender Faktor dafür zu sein scheint, wie kleine Mengen von α-Synuclein Schäden verursachen.
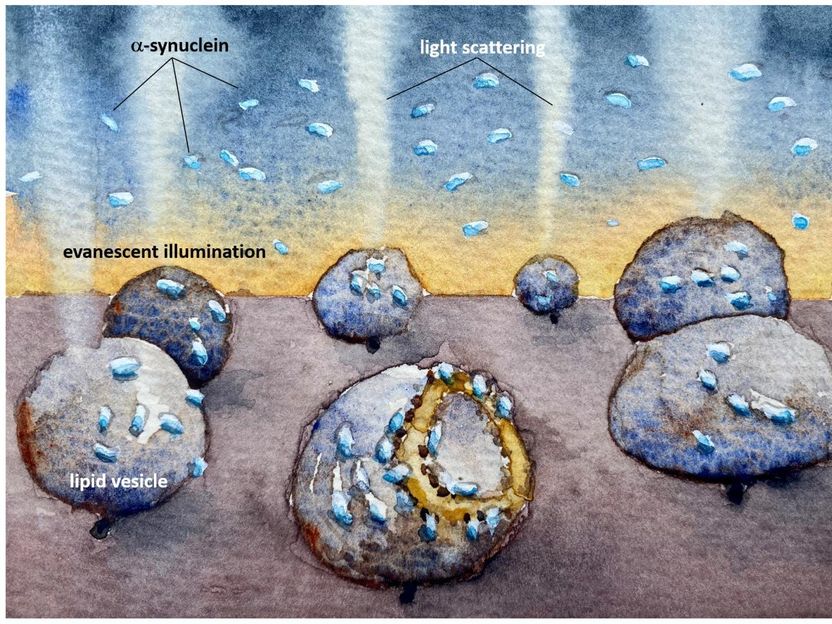
Eine Illustration, die zeigt, wie die Mitochondrien-imitierenden Lipidvesikel durch das Parkinson-Protein Alpha-Synuclein geschädigt werden. Die Lichtstreuung zeigt, wie die Membran selbst bei sehr niedrigen, nanomolaren Konzentrationen, bei denen die Proteine nicht zu Klumpen aggregieren, bevor sie binden, zerstört wird.
Fredrik Höök/Chalmers University of Technology
Die Parkinson-Krankheit ist ein unheilbarer Zustand, bei dem die Neuronen, die Nervenzellen des Gehirns, allmählich zerfallen und die Gehirnfunktionen gestört werden. Zu den Symptomen können unfreiwillige Erschütterungen des Körpers gehören, und die Krankheit kann großes Leid verursachen. Um Medikamente zu entwickeln, die die Krankheit verlangsamen oder stoppen, versuchen Forscher die molekularen Mechanismen zu verstehen, die hinter α-synuclein zur Degeneration von Nervenzellen beitragen.
Es ist bekannt, dass die Mitochondrien, die energieproduzierenden Kompartimente in den Zellen, bei der Parkinson-Krankheit geschädigt werden, was möglicherweise auf die "Amyloide" von α-Synuclein zurückzuführen ist. Amyloide sind Klumpen von Proteinen, die zu langen Fasern mit einer gut geordneten Kernstruktur angeordnet sind, und ihre Bildung liegt vielen neurodegenerativen Erkrankungen zugrunde. Amyloide oder noch kleinere Klumpen von α-Synuclein können sich an mitochondriale Membranen binden und diese zerstören, aber die genauen Mechanismen sind noch unbekannt.
Die neue Studie, die kürzlich in der Fachzeitschrift PNAS veröffentlicht wurde, konzentriert sich auf zwei verschiedene Arten membranartiger Vesikel, bei denen es sich um "Kapseln" von Lipiden handelt, die als Nachahmer der in Zellen vorkommenden Membranen verwendet werden können. Eines der Vesikel besteht aus Lipiden, die häufig in synaptischen Vesikeln zu finden sind, das andere enthält Lipide, die mit mitochondrialen Membranen verwandt sind.
Die Forscher fanden heraus, dass das Parkinson-Protein an beide Vesikeltypen binden würde, aber nur strukturelle Veränderungen an den mitochondrienähnlichen Vesikeln verursachte, die sich asymmetrisch verformten und deren Inhalt austrat.
"Jetzt haben wir eine Methode entwickelt, die empfindlich genug ist, um zu beobachten, wie α-Synuclein mit einzelnen Modellvesikeln interagiert. In unserer Studie beobachteten wir, dass α-Synuclein an mitochondrienähnliche Membranen bindet - und diese zerstört, aber es gab keine Zerstörung der Membranen von synapsenähnlichen Vesikeln. Die Schädigung tritt bei sehr niedriger, nanomolarer Konzentration auf, wo das Protein nur als Monomere - nicht aggregierte Proteine - vorliegt. Eine so niedrige Proteinkonzentration war bisher schwer zu untersuchen, aber die Reaktionen, die wir jetzt entdeckt haben, könnten ein entscheidender Schritt im Verlauf der Krankheit sein", sagt Pernilla Wittung-Stafshede, Professorin für Chemische Biologie am Fachbereich Biologie und Biologieingenieurwesen.
Die neue Methode der Forscher der Chalmers University of Technology ermöglicht es, winzige Mengen biologischer Moleküle ohne Verwendung von Fluoreszenzmarkern zu untersuchen. Dies ist ein großer Vorteil bei der Verfolgung natürlicher Reaktionen, da die Marker oft die zu beobachtenden Reaktionen beeinflussen, besonders wenn man mit kleinen Proteinen wie α-Synuclein arbeitet.
"Die chemischen Unterschiede zwischen den beiden verwendeten Lipiden sind sehr gering, aber dennoch haben wir dramatische Unterschiede in der Wirkung von α-synuclein auf die verschiedenen Vesikel beobachtet", sagt Pernilla Wittung-Stafshede.
"Wir glauben, dass die Lipidchemie nicht der einzige bestimmende Faktor ist, sondern dass es auch makroskopische Unterschiede zwischen den beiden Membranen gibt - wie zum Beispiel die Dynamik und die Wechselwirkungen zwischen den Lipiden. Niemand hat sich wirklich genau angesehen, was mit der Membran selbst passiert, wenn α-synuclein an sie bindet, und niemals bei diesen niedrigen Konzentrationen".
Der nächste Schritt für die Forscher ist die Untersuchung von Varianten des α-Synuclein-Proteins mit Mutationen, die mit der Parkinson-Krankheit assoziiert sind, sowie die Untersuchung von Lipidvesikeln, die den Zellmembranen ähnlicher sind.
"Wir wollen auch quantitative Analysen durchführen, um auf mechanistischer Ebene zu verstehen, wie einzelne Proteine, die sich auf der Oberfläche der Membran sammeln, Schäden verursachen können", sagt Fredrik Höök, Professor am Fachbereich Physik, der ebenfalls an der Forschung beteiligt war.
"Unsere Vision ist es, die Methode weiter zu verfeinern, so dass wir nicht nur einzelne, kleine - 100 Nanometer - Lipidvesikel untersuchen können, sondern auch jedes Protein einzeln verfolgen können, auch wenn sie nur 1-2 Nanometer groß sind. Das würde uns helfen zu zeigen, wie kleine Variationen in den Eigenschaften von Lipidmembranen zu einer so unterschiedlichen Reaktion auf die Proteinbindung beitragen, wie wir sie jetzt beobachtet haben".
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.