„Molekularer Klebstoff“ – Forschung an einer neuen Waffe gegen Krebstreiber
Wirkmechanismus einer neu entdeckten zellulären Krebsbremse aufgeklärt
Wissenschaftler haben auf der Suche nach neuen Krebsmedikamenten insbesondere wachstumsfördernde Proteine ins Visier genommen. Da diese Krebstreiber mit den vorhandenen Medikamenten oft nur schwer zu bremsen sind, werden dringend alternative Therapieansätze benötigt. In Zusammenarbeit mit dem Deutschen Krebsforschungszentrum (DKFZ) und dem Nationalen Centrum für Tumorerkrankungen (NCT) Heidelberg haben Forscher aus Boston und Basel nun den Wirkmechanismus einer neu entdeckten zellulären Krebsbremse aufgeklärt. Dieses Molekül verbindet krebstreibende Proteine mit einem Bestandteil des zellulären Entsorgungssystems. Als „molekularer Klebstoff“ sorgt es dafür, dass der Krebstreiber abgebaut und das Zellwachstum gehemmt wird. Die Forschungsergebnisse eröffnen neue Wege in der Wirkstoffentwicklung für die Behandlung von Krebs.
Die meisten klinisch eingesetzten zielgerichteten Krebsmedikamente sind kleine Moleküle, die die Aktivität von wachstumsfördernden Proteinen blockieren. Von allen bekannten Krebstreibern bieten aber nur wenige geeignete Angriffspunkte für diese Wirkstoffe. Ein neuartiger Ansatz umgeht diese Schwierigkeit und macht sich einen zelleigenen Ablauf zunutze, der nicht mehr benötigte Proteine abbaut und damit entsorgt.
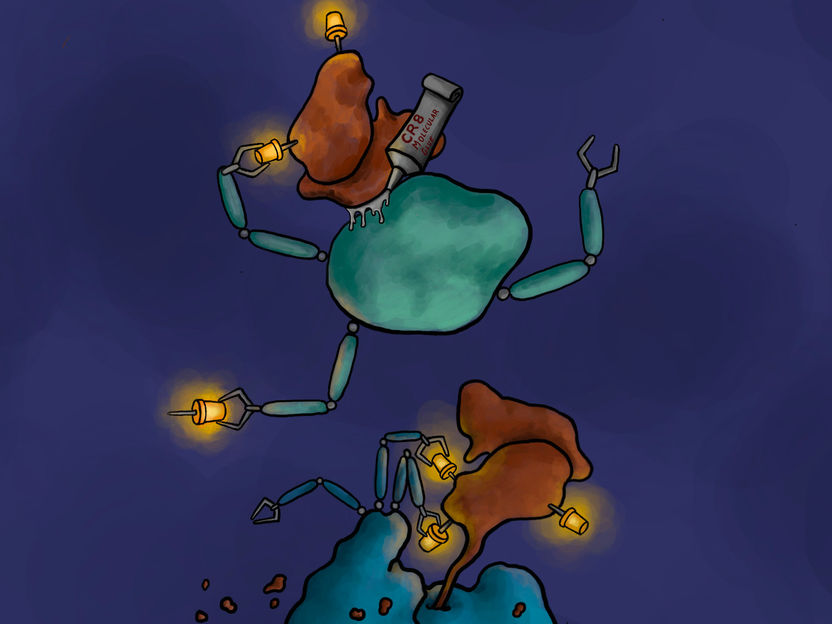
Wie ein „molekularer Klebstoff“ funktioniert. Der Kinaseinhibitor CR8 verbindet den krebstreibenden CDK12/Cyclin K-Komplex (braun) mit einer E3-Ligase (grün). Diese Interaktion bewirkt, dass Cyclin K an Ubiquitin-Moleküle (gelb) gebunden wird. Auf diese Weise markierte Cyclin-K-Moleküle können vom Entsorgungssystem der Zelle erkannt und abgebaut werden (blau).
Copyright: Jonas Koeppel
Ein wichtiger Bestandteil dieses Entsorgungssystems sind die sogenannten E3-Ligasen. Diese Enzyme regulieren die Aktivität vieler Proteine in der Zelle. In den letzten Jahren haben sie sich zu einem vielversprechenden Ziel für neue Arzneimittel entwickelt, um krankheitsverursachende Proteine selektiv zu zerstören und zu entfernen. Das bekannteste Beispiel für einen solchen Wirkstoff ist Thalidomid. Er bringt als eine Art „molekularer Klebstoff“ ein krebsförderndes Protein in unmittelbare Nähe zu einem E3-Ligase-Rezeptor. Durch das Verkleben der beiden wird der Krebstreiber für die Entsorgung markiert, sodass er gezielt abgebaut werden kann. Das Thalidomid-Analogon Lenalidomid ist in Deutschland für die Behandlung bestimmter Blutkrebsarten, des multiplen Myeloms und des myelodysplastischen Syndroms, zugelassen.
„Um weitere Substanzen aus der neuen Gruppe der molekularen Klebstoffe zu identifizieren, untersuchten wir Tausende von Medikamenten auf ihre Fähigkeit, das Wachstum von Krebszellen zu hemmen. Dabei spielte die Menge an E3-Ligasen in einer Zelle eine entscheidende Rolle“, berichtet Mikołaj Słabicki, Postdoktorand am Dana-Farber Cancer Institute (DFCI) in Boston und in der Abteilung für Translationale Medizinische Onkologie am DKFZ und am NCT Heidelberg, und Erstautor der Studie. „Wir entdeckten, dass das Molekül CR8 das Wachstum von Krebszellen hemmt, indem es eine E3-Ligase an bestimmte wachstumsfördernde Proteine koppelt.“
Bei der genaueren Charakterisierung von CR8 fanden die Forscher eine strukturelle Ähnlichkeit zu einem bereits bekannten Kinasehemmer mit dem Namen Roscovitin oder Seliciclib. „Wir konnten zeigen, dass es möglich ist, einen konventionellen Kinaseinhibitor durch Anhängen einer bestimmten chemischen Gruppe in einen molekularen Klebstoff umzuwandeln“, sagt Seniorautor Benjamin Ebert vom DFCI und Träger des Meyenburg-Krebsforschungspreises 2019.
Die molekularen Details des CR8-induzierten Klebstoffkomplexes wurden von Forschern des Friedrich-Miescher-Instituts für Biomedizinische Forschung (FMI) in Basel, darunter Co-Seniorautor Nicolas Thomä und die Co-Erstautoren Zuzanna Kozicka und Georg Petzold, aufgedeckt. Die Teams auf beiden Seiten des Atlantiks entdeckten, dass eine kleine chemische Gruppe erforderlich ist, damit CR8 als molekularer Kleber wirken kann. „Dies könnte eine Strategie für die Entwicklung von Medikamenten sein und zu neuen Optionen für die Behandlung von Krebs führen“, sagt Kozicka.
Die Suche nach neuartigen „molekularen Klebstoffen“ war eine gemeinsame Anstrengung von Wissenschaftlern des DFCI, des Broad Institute of Harvard and Massachusetts Institute of Technology in Cambridge sowie des FMI in Zusammenarbeit mit Forschern des DKFZ und des NCT Heidelberg, darunter zwei Studenten, Manisha Manojkumar und Jonas Koeppel.
„Diese Studie war echte Detektivarbeit, wobei jedes Experiment zusätzliche Puzzleteile aufdeckte. Sie erforderte eine multidisziplinäre Anstrengung von Teammitgliedern aus verschiedenen Bereichen, darunter Krebsbiologie, Bioinformatik, funktionelle Genomik, Strukturbiologie und Biochemie“, sagt Słabicki.