Umweltfreundliche Produktion von Mandelsäure
Neues Verfahren zur "grünen" Produktion eines wichtigen Ausgangsstoffes der chemischen Industrie entwickelt
Manchmal sind potenziell nützliche Enzyme nicht leicht zu erkennen, weil manche ihrer enzymatischen Fähigkeiten außerhalb des natürlichen und damit bekannten Wirkbereiches liegen. Eine solche Entdeckung machte ein Forscherteam des Max-Planck-Instituts für terrestrische Mikrobiologie unter der Leitung von Tobias Erb - und fand damit einen Weg, um Mandelsäure, einen wichtigen Ausgangsstoff der chemischen Industrie, auf „grüne“ Weise zu produzieren.
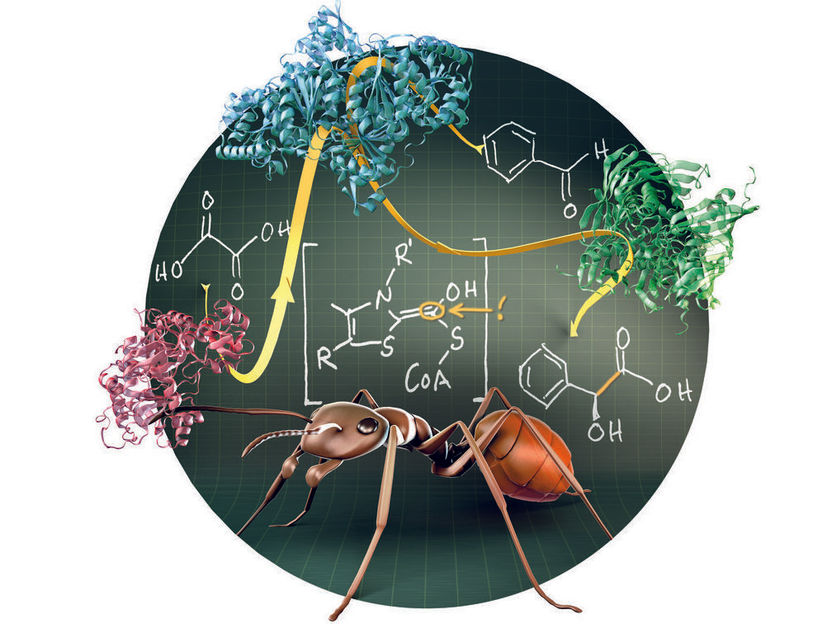
Ameisensäure, Hauptbestandteil des Ameisengiftes, spielt eine Schlüsselrolle bei der enzymatischen Synthese von Mandelsäure. Eine Kaskade von drei Enzymen vermittelt die Umwandlung der preiswerten und sicheren Ausgangsstoffe Oxalsäure und Benzaldehyd unter milden Bedingungen in Mandelsäure, einem wichtigen Rohstoff der chemischen Industrie.
© Max-Planck-Institut für terrestrische Mikrobiologe/Burgener
Die chemische Produktion von Stoffen ist leistungsfähig, aber mit hohen Kosten verbunden: die Verwendung toxischer Substanzen, damit verbundenen Umweltgefahren und der Einsatz von nicht nachhaltigen Ressourcen. Die Synthese von Mandelsäure bildet da keine Ausnahme. Bei der Herstellung der Feinchemikalie, die in Kosmetika und als Baustein für Medikamente und Aromen verwendet wird, wird die extrem giftige Verbindung Zyanid benötigt.
Im Gegensatz zu uns Menschen nutzen die Mikroorganismen Enzyme, um einfache Ausgangssubstanzen in wertvolle chemische Verbindungen umzuwandeln, ein Prozess, den man Fermentation nennt. Die Menschen haben seit jeher von den mikrobiellen Fähigkeiten profitiert, sei es beim Brauen von Bier, der Herstellung von Käse oder bei der modernen Produktion von Insulin. Allerdings lassen sich die meisten in der Natur vorkommenden Mikroorganismen im Labor nicht kultivieren oder sie können die gewünschten Stoffe nicht produzieren. Daher kommt der synthetischen Biologie in der Nutzung des fermentativen Potentials im Hinblick auf die Umstellung der chemischen Industrie auf „grüne“ Verfahren eine Schlüsselrolle zu.
Altbekannte Enzyme in neuer Kombination
Manchmal besitzen Enzyme Fähigkeiten, die jenseits ihres natürliches Einsatzgebietes liegen. Eine solche Entdeckung machte ein Forscherteam unter Leitung von Tobias Erb: eine bislang unbekannte enzymatische Fähigkeit des Enzyms Oxalyl-CoA-Decarboxylase (OXC). In der Natur spielt OXC eine wichtige Rolle beim Abbau des schwerlöslichen Calciumoxalats, einem Hauptbestandteil von Harn- und Nierensteinen. Wie sich herausstellte, vermittelt das Enzym darüber hinaus die Bindung zwischen Kohlenstoffatomen.
Dabei entsteht als Zwischenprodukt eine hochreaktive Form der Ameisensäure. Diese kondensiert mit einem Aldehyd, einem weiteren sehr reaktiven Molekül. Die Forscher verbesserten den Biokatalysator durch gezielte Mutationen und kombinierten sie mit zwei weiteren Enzymen. Sie schufen damit eine Kaskade von drei Schritten, die aus den kostengünstigen und sicherheitstechnisch unbedenklichen Stoffen Oxalsäure und Benzaldehyd unter milden Bedingungen den wertvollen Ausgangsstoff Mandelsäure herstellt. Darüber hinaus gelang es ihnen, eine breite Palette von Mandelsäurederivaten zu synthetisieren, die bei der Entwicklung neuer Medikamente sehr nützlich sein können.
Biokatalysatoren in der synthetischen Biologie
Bislang beruht diese Methode noch auf hochreinen Enzymen. Durch ihren Einbau in ein Bakterium oder ein synthetisches System ließe sich in der Zukunft aber eine umweltfreundliche und nachhaltige Produktion der Mandelsäure und ihrer Derivate realisieren. In einem breiteren Kontext unterstreichen die vorliegenden Ergebnisse das enorme Potenzial von Enzymen und zeigen, dass bereits bekannte Enzyme neuartige, sehr nützliche Aktivitäten haben können. Tatsächlich sind die Funktionen der bisher bekannten Enzyme nur die Spitze des Eisbergs. Die weitere Erforschung dieser vielseitigen Biokatalysatoren schafft die Voraussetzung, enzymatische Synthesen zu einer leistungsfähigeren Alternative zur chemischen Synthese zu machen.
Originalveröffentlichung
Burgener, S.; Cortina, N.S.; Erb, T.J.; "Oxalyl‐CoA Decarboxylase Enables Nucleophilic One‐Carbon Extension of Aldehydes to Chiral α‐Hydroxy Acids"; Angewandte Chemie; 59, 5526-5523 (2020)





















































