Verkannte Proteintröpfchen
Neuer Mechanismus für die Entstehung von Erbkrankheiten entdeckt
Wiederholungen von einzelnen Bausteinen innerhalb von Proteinen sind Ursache vieler Erbkrankheiten – weshalb, ist häufig unbekannt. Am Beispiel der Synpolydaktylie untersuchten Berliner Forschende, auf welche Weise die Genveränderung sie hervorruft. Ihr Ergebnis: Die gegenseitige Anziehungskraft von Proteinen wird so beeinflusst, dass sie nicht mehr in der richtigen Zusammensetzung in feinen Tropfen in der Zelle zusammenfinden. Auf diese Art könnten auch viele andere Erbkrankheiten erklärt werden.
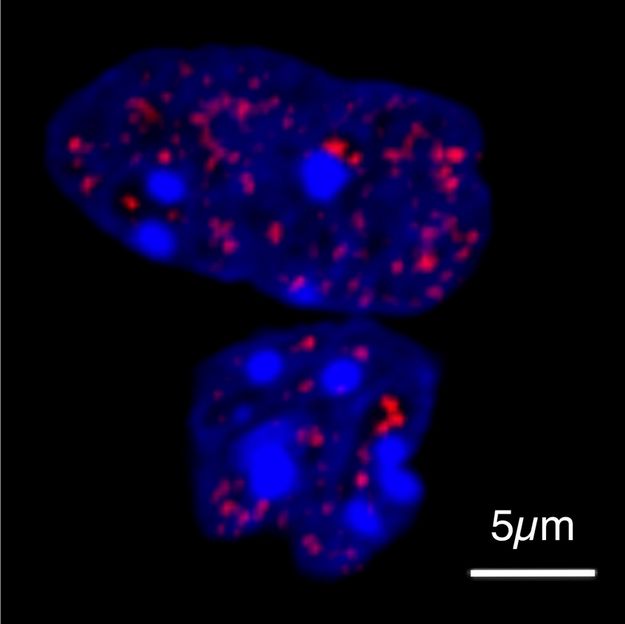
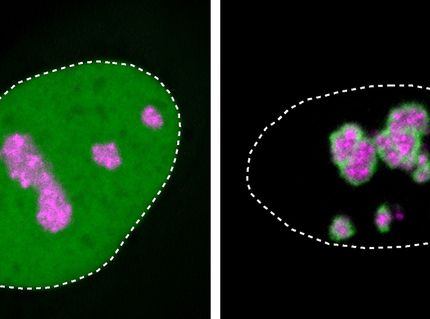
Zellkerne von Zellen in der Kultur unter dem Mikroskop. Kondensate, die das Protein HOXD13 enthalten, erscheinen rot. Die DNA ist blau gefärbt.
© MPI f. Molecular Genetics/ Shaon Basu
Fünf Finger an der Hand, fünf Zehen am Fuß, ja die gesamte Symmetrie unseres Körpers steuern die HOX-Gene während der Entwicklung. Die Gruppe von Genen hat eine grundlegende Bedeutung für die Gliederung des sich entwickelnden Embryos entlang der Körperachsen.
Ist etwa das Gen HOXD13 fehlerhaft, können überzählige Finger entstehen und miteinander verwachsen. Die genauen molekularen Abläufe, wie dieser Gendefekt zu Synpolydaktylie (von griech. syn „zusammen“, polys „viel“, dáktylos „Finger“) führt, waren jedoch bislang unbekannt.
Ein Team um die Wissenschaftler Denes Hnisz und Daniel Ibrahim am Max-Planck-Institut für molekulare Genetik in Berlin fand jetzt heraus, dass die Genveränderung die Bildung von Proteinen mit veränderten chemischen Eigenschaften nach sich zieht. Diese lagern sich nicht mehr im richtigen Mischungsverhältnis mit anderen Molekülen zu winzigen Tröpfchen in der Zelle zusammen – was jedoch die Voraussetzung für ihre korrekte Funktion ist. Das Forschungsteam beschreibt damit einen neuen Mechanismus für die Entstehung von erblichen Krankheiten.
Proteintröpfchen bezwingen den Zufall
Doch weshalb lagern sich Proteine überhaupt zu Tröpfchen zusammen? „Wie in einem Salatdressing das Essig kleine Tröpfchen im Öl bildet, verbinden sich auch in der Zelle bestimmte Moleküle zu tropfenartigen Gebilden, die wir Kondensate nennen,“ erklärt Studienleiter Denes Hnisz. Durch ihre chemischen Eigenschaften ziehen sich die Moleküle gegenseitig an und grenzen sich damit von ihrer Umgebung ab.
Für dieses Phänomen gibt es praktische Gründe. „Um ein einziges Gen abzulesen, braucht die Zelle 300 bis 500 Proteine“, sagt Hnisz. „Müsste sich diese gigantische Maschinerie durch reinen Zufall am richtigen Ort zusammenfinden, bräuchte es rein rechnerisch ganze zehn Milliarden Jahre.“ Die Zelle bündelt daher Moleküle, die sie für eine bestimmte Aufgabe benötigt in tropfenartigen „Paketen“.
Anziehungskräfte bestimmen Zusammensetzung
Moleküle wie die HOX-Proteine bestehen aus unterschiedlichen Abschnitten, von denen einige eine feste dreidimensionale Struktur aufweisen, während andere als „intrinsisch ungeordnete Regionen (IDR) keine feste Form haben. „Diese Molekülschwänze hängen aus den Proteinen heraus wie gekochte Spaghetti“, sagt Hnisz. „Wir glauben, dass sie ganz entscheidend für die Bildung von Kondensaten sind.“
Auch HOXD13 besitzt einen solchen Fortsatz, der zudem besonders zahlreiche Bausteine der Aminosäure Alanin enthält. „Bei Erkrankten mit Synpolydaktylie ist dieser Alanin-Schwanz verlängert, von gesunden 15 um mindestens sieben zusätzliche Alanine“, sagt der Entwicklungsbiologe Daniel Ibrahim, der sich auf genetisch bedingte Fehlbildungen des Skeletts spezialisiert hat. Er arbeitet in der Arbeitsgruppe des Genetiker Stefan Mundlos, der HOXD13-Mutationen als Ursache der Synpolydaktylie erstmals 1996 beschrieb und derzeit am MPIMG forscht. Die molekularen Mechanismen der Krankheit blieben aber stets rätselhaft.
Veränderte Proteine haben anderes Verhalten
Um zu überprüfen, ob verlängerte Schwanz von HOXD13 die Arbeitsweise des Proteins beeinflusst, mischte Shaon Basu, einer der beiden Erstautoren der Studie, zunächst HOXD13-Moleküle unterschiedlicher Länge mit weiteren Proteinen, die es für seine Funktion benötigt. Je länger der Molekülschwanz war, desto stärker verdrängte er seine Bindungspartner aus dem Tröpfchen. Zusammen mit einem Team von der Freien Universität Berlin wiesen die Forschenden dieses Verhalten mittels hochauflösender Mikroskopie in lebenden Zellen aus Zellkulturen nach.
Aber ist das Verdrängen der Bindungspartner tatsächlich von Bedeutung für die Steuerfunktion von HOXD13? „Wir haben uns das in Embryonen von Mäusen mit verlängertem HOXD13-Gen angeschaut, die wie menschliche Patienten Synpolydaktylien entwickeln“, sagt Ibrahim. In den zwölfeinhalb Tage alten Embryonen waren die Kondensattröpfchen in den Zellen der sich entwickelnden Gliedmaßen anders zusammengesetzt als bei Mäusen ohne die Genveränderung. Bei ihnen wuchsen zum Beispiel auch weniger Zellen, die zuerst für Platz zwischen den Fingern sorgen und später wieder verschwinden. „Möglicherweise können wir die Zusammensetzung der mutierten Kondensate mit chemischen Verbindungen wie Medikamenten verändern“, sagt Basu. „Ich denke, es gibt eine echte und faszinierende Chance, dass wir eines Tages die Entwicklung der Krankheit eliminieren könnten, indem wir den zugrundeliegenden Mechanismus korrigieren.“
Auch für andere Krankheiten relevant
Nicht nur HOXD13 hat einen Proteinfortsatz, der über das Verhalten im Kondensat und seine Funktion beeinflusst. Der Bioinformatiker Sebastian D. Mackowiak, gemeinsam mit Basu Erstautor der Studie ist, analysierte weitere 1.500 menschliche Steuerproteine mit Molekülschwänzen und klassifizierte sie anhand ihrer chemischen Eigenschaften in sieben Gruppen. Eine Gruppe enthielt mehrere Proteine, die wie HOXD13 einen hohen Anteil der Aminosäure Alanin besaßen. Die Forschenden veränderten den Alanin-Anteil einiger der so identifizierten Proteine und testeten sie in Zellkulturen. Tatsächlich war die Zusammensetzung der Kondensattröpfchen jedes Mal verändert, was die Funktion der Proteine behinderte.
Die Arbeit ist für Hnisz und seine Kolleginnen und Kollegen ein besonderer Triumph. Denn Kondensate in Form kleiner zellulärer Kügelchen wurden bei mikroskopischen Untersuchungen schon vor Jahrzehnten beschrieben, ihre funktionelle Bedeutung jedoch vielfach angezweifelt. „Dass Kondensate direkt mit der Entstehung von Krankheiten zu tun haben, kann man nach unserer Forschungsarbeit nicht mehr von der Hand weisen“, sagt Hnisz. „Es ist absolut plausibel, dass auch andere Krankheiten durch die eine veränderte Zusammensetzung zellulärer Kondensate verursacht werden.“