Wie Signalmoleküle die frühe Embryonalentwicklung steuern
Langfristig kann dieses Verständnis dazu beitragen gezielt Gewebe für die regenerative Medizin zu züchten
Während der Embryonalentwicklung müssen Zellen ihren Bestimmungsort und ihre Aufgabe im entstehenden Organismus genau kennen, damit das Lebewesen seine Form annimmt und Körperteile sowie Organe entstehen. Entscheidend sind dafür zwei Signalmoleküle namens Nodal und BMP. Ein interdisziplinäres Team um Patrick Müller am Friedrich-Miescher-Laboratorium der Max-Planck-Gesellschaft in Tübingen hat nun herausgefunden, wie diese Signalmoleküle sich so im heranreifenden Embryo verteilen, dass letztlich ein Code entsteht, der jeder Zelle ihren Platz und ihre Eigenschaften zuweist.
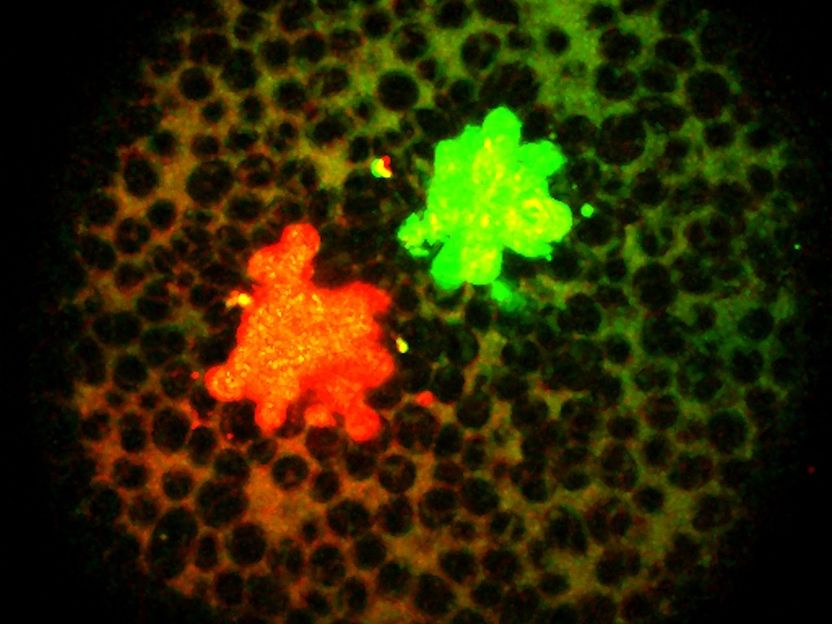
Abbildung der mit Fluoreszenzfarbstoffen versehenen Signalmoleküle
Friedrich Miescher Laboratory, Tübingen/ Germany
Damit haben die Wissenschaftler nicht nur einen grundlegenden Mechanismus der frühen Embryonalentwicklung entschlüsselt. Ein besseres Verständnis dieser frühen Vorgänge kann möglicherweise auch dazu beitragen, in Zukunft gezielt Gewebe für die regenerative Medizin zu züchten.
Es ist wie ein gut abgestimmter Tanz: In der frühen Embryonalentwicklung wandern Zellen aus einem scheinbar unsortierten Haufen an ihren Bestimmungsort und prägen dort bestimmte Eigenschaften aus. So entstehen aus dem Zellhaufen Muster, aus denen sich schließlich die Achsen des Embryos entwickeln, entlang derer die Körperteile entstehen. Die Choreografie des Tanzstücks übernehmen Signalmoleküle. Sie weisen den neu entstandenen unreifen Zellen des Embryos ihren Platz zu und sorgen dafür, dass sie bei ihrem Reifungsprozess die vorgesehenen Eigenschaften annehmen, so dass sich etwa Gliedmaße oder Organe ausbilden.
Zu den Choreografen, den Schlüsselfaktoren der frühen Embryonalentwicklung, zählen die Signalmoleküle Nodal und BMP. Nodal bestimmt, wo das Innere des Embryos sein wird, und BMP legt fest, wo die Bauchseite (ventral) und die Rückenseite (dorsal) entstehen. Auch für die Körperachse vom Kopf bis zum Schwanz zeichnen diese beiden Signalmoleküle verantwortlich. Werden Nodal und BMP im Labor künstlich in Zebrafisch-Embryonen eingebracht, kann dies sogar dazu führen, dass eine vollständige zweite Achse – ein siamesischer Zwilling – entsteht.
Entscheidend für die Entwicklung der Achse ist das Verhältnis zwischen Nodal und BMP. „Entlang der Achse entsteht ein Gradient aus beiden Molekülen, und je nachdem wieviel Nodal beziehungsweise BMP vorhanden ist, wird das weitere Schicksal der embryonalen Zellen in diesem Bereich festgelegt“, erklärt Gary Soh, Erstautor der Veröffentlichung. Liegt viel Nodal aber wenig BMP vor, so entstehen die Strukturen des Kopfes; ist das Verhältnis umgekehrt und BMP überwiegt, so wird der Schwanz gebildet. Unklar war bislang allerdings, wie dieser Gradient entsteht, und durch welche Mechanismen die Zellen des Embryos überhaupt in der Lage sind, auf diesen Gradienten zu reagieren.
Um dieser Frage nachzugehen, haben Soh und seine Kollegen Nodal und BMP mit Fluoreszenzfarbstoffen versehen und dann verfolgt, wie – ausgelöst durch diese Signalmoleküle – im Verlauf der Zebrafisch-Entwicklung eine zweite Achse entsteht. Da Zebrafisch-Embryonen durchsichtig sind, konnten die Forscher beobachten, wie sich beide Signalmoleküle im Embryo verteilen. Das überraschende Ergebnis: Nodal und BMP weisen eine sehr ähnliche Verteilung auf.
Wie aber kommt es, dass bei dieser ähnlichen Verteilung die Zellen des Embryos entlang der Körperachse in ihrem Reifungsprozess unterschiedliche Aufgaben übernehmen? Hier kommen weitere Signalmoleküle ins Spiel: Moleküle aus der so genannten Smad-Familie. Nodal und BMP aktivieren diese Moleküle – aber nicht gleichermaßen, wie die Forscher herausgefunden haben. Mit Hilfe mathematischer Modelle und exakten Messungen stellten sie fest, dass Nodal Smad 2 anregt, und zwar relativ langsam. BMP dagegen aktiviert sehr zügig das Smad5-Molekül. In der Folge treten die aktivierten Smad-Moleküle entlang der entstehenden Achse in unterschiedlichen Konzentrationen auf. „Wir beobachten, dass Zellen unterschiedliche Entwicklungswege einschlagen, je nachdem, wie das Verhältnis zwischen aktiviertem Smad2 und Smad5 aussieht“, erklärt Soh. „Durch dieses Verhältnis entsteht eine Art Code, der letztlich steuert, welche Eigenschaften die Zellen des Embryos an bestimmten Positionen ausbilden.“
Die Wissenschaftler haben damit einen grundlegenden Mechanismus der frühen Embryonalentwicklung aufgeklärt. Dies dient zunächst dazu, die frühen Entwicklungsprozesse des Lebens besser zu verstehen. Langfristig kann dieses Verständnis aber auch dazu beitragen, für die regenerative Medizin gezielt Stammzellen zu Geweben mit bestimmten Eigenschaften heranreifen zu lassen – als möglichen Ersatz für kranke oder abgestorbene Körpergewebe.
Originalveröffentlichung
Soh GH, Pomreinke AP, Müller P (2020); "Integration of Nodal and BMP signaling by mutual signaling effector antagonism"; Cell Reports, 31:107487