Fabrik der Zukunft wächst auf dem Acker
Pflanzen als Bioreaktoren
Die Fabrik der Zukunft wächst auf dem Acker – zumindest wenn es nach Ralph Bock und seinem Team am Max-Planck-Institut für molekulare Pflanzenphysiologie in Golm geht. Die Forscher wollen Pflanzen zu Produktionsstätten für Substanzen machen, die sonst nur aufwendig und teuer herzustellen sind. Eine zuletzt eher verpönte Pflanze könnte dabei eine unerwartete Renaissance erleben.

Künftig könnten Tabakpflanzen nicht mehr nur für Zigaretten und Zigarren, sondern auch zur Produktion von Farb- oder Impfstoffen genutzt werden (Symbolbild)
distelAPPArath, pixabay.com, CC0
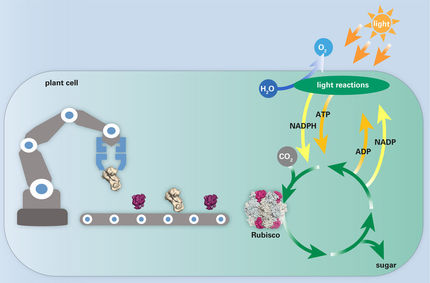
Nur mit Luft und Liebe wachsen Pflanzen nicht. Sie können aber aus vergleichsweise wenigen Ausgangssubstanzen eine unglaubliche Vielfalt an Inhaltsstoffen herstellen: Kohlendioxid aus der Luft und das Licht der Sonne, dazu noch Wasser und Mineralien. Das sind die Zutaten, mit denen Pflanzenzellen Kohlenhydrate produzieren – ein Prozess, der als Fotosynthese bezeichnet wird. Die Zucker sind die Basis für eine riesige Palette kohlenstoffhaltiger Substanzen: Zellulose, Stärke, Fettsäuren, Aminosäuren, Proteine, Hormone, Vitamine sowie diverse Farb- und Duftstoffe und Gifte. All dies stellen Pflanzen für ihren Eigenbedarf her und ernähren ganz nebenbei damit noch Mensch und Tier.
Die „grünen Fabriken“ arbeiten äußerst effizient, nachhaltig und erzeugen keinen umweltschädlichen Abfall. Im Gegenteil: Abgestorbene Pflanzenteile werden von Mikroorganismen vollständig zersetzt und wieder die Stoffkreisläufe eingeschleust. All diese Eigenschaften lassen bis heute jeden Chemiker vor Neid erblassen. Aber könnte man die Fähigkeiten der Pflanzen nicht noch stärker für den Menschen nutzbar machen?
„Molecular farming“ oder „Molekulare Landwirtschaft“ heißt dieses Konzept. Ein besonders vielversprechender Ansatz beruht auf gezielten Erbgutveränderungen in den sogenannten Chloroplasten – den Organellen innerhalb der Pflanzenzellen für die Fotosynthese. Die Chloroplasten besitzen ihr eigenes Erbgut und können so einen Teil der Proteine für die Fotosysnthese selbst herstellen.
Mit den Veränderungen im Erbgut will Ralph Bock seine Pflanzen dazu bringen, für den Menschen wichtige Substanzen zu produzieren. Zum Beispiel den Farbstoff Astaxanthin. Die Substanz wird von der einzelligen Meeresalge Haematococcus pluvialis erzeugt und ist ein starkes Antioxidans. In der Natur nehmen Fische und Krebstiere Astaxanthin über die Nahrung auf und bilden dadurch rötliches Muskelgewebe. Zuchtlachsen dagegen muss der Farbstoff extra gefüttert werden, ansonsten bleibt ihr Fleisch weiß und kann nicht so teuer verkauft werden. Astaxanthin ist aber kein ganz billiges Nahrungsergänzungsmittel: Ein Kilo kostet 15.000 Dollar, wenn es in einem aufwendigen Verfahren aus den Algen herausgelöst werden muss. Bock und sein Team setzen stattdessen auf Tabakpflanzen: „Wenn wir den Stoffwechselweg zur Bildung von Astaxanthin in die Pflanzen einbauen, können die Pflanzen es wesentlich preiswerter produzieren“, erzählt Bock.
Aktivierung von Chloroplasten-Genen
Wieviel Astaxanthin die Blätter des genetisch veränderten Tabaks produzieren, sieht man auf den ersten Blick an ihrer orangen Farbe. Unter dem Mikroskop zeigt sich, dass dies an den Chloroplasten liegt, die dicht an dicht in jeder Pflanzenzelle sitzen: Beim normalen Tabak wegen des natürlichen Blattfarbstoffs Chlorophyll leuchtend grün, färben die Astaxanthin-Kristalle sie nun knallig orange. Aber warum zweckentfremden die Forscher die Chloroplasten als Bioreaktoren und nicht gleich die gesamte Pflanzenzelle? „Nach Jahren intensiver Forschung wissen wir heute, dass sich fremde Gene in den Chloroplasten leichter aktivieren lassen“, erklärt Bock. „Außerdem werden sie nur mütterlicherseits vererbt. Es besteht deshalb kaum Gefahr, dass veränderte Gene über Blütenpollen auf Nachbarfelder zu unveränderten Pflanzen geweht werden.“ Ein weiterer wesentlicher Vorteil ist, dass jeder Chloroplast bis zu 100 Kopien eines Gens besitzt. Das ergibt bei rund 100 Chloroplasten pro Zelle 10.000 Kopien. „Auf diese Weise können wir viel größere Mengen einer Substanz herstellen“, sagt Bock.
Tabak, ohnehin eine der Modellpflanzen der Biologie, ist für molekulares Farming im großen Stil ideal. Sein Erbgut lässt sich aus unbekannten Gründen leichter und schneller verändern als das anderer Pflanzen. Zudem wächst Tabak sehr schnell, so dass seine Blätter mehrmals im Jahr geerntet werden können.
Hinzu kommt eine gesellschaftliche Entwicklung: Seit Tabak immer weniger für Zigaretten benötigt wird, kämpfen viele Tabakfarmer in den USA ums Überleben. „Die Bauern in Kentucky und Virginia sind sehr konservativ. Für sie ist es undenkbar, auf Weizen, Mais oder Kartoffeln umzusteigen“, erzählt Bock. Die schon vorhandenen Anbauflächen für Tabak könnten also weiter genutzt werden, und die Tabakbauern hätten wieder eine Perspektive – eine klassische win-win-Situation also. Aber noch eine weitere Eigenschaft prädestiniert den Tabak geradezu zum pflanzlichen Bioreaktor: seine Giftigkeit. Das Nikotin in den Blättern ist so toxisch, dass schon der Verzehr eines einzigen Blattes einen Menschen töten kann. „Wer pharmazeutisch wirksame Substanzen in einer Pflanze produzieren will, möchte natürlich unter allen Umständen vermeiden, dass diese Stoffe in den Nahrungskreislauf gelangen. Wenn eine Pflanze von vornherein ungenießbar ist, ist diese Gefahr natürlich sehr gering“, sagt Bock.
Algen fürs Fischfutter
Als Fischfutter für Zuchtlachse ist Astaxanthin-haltiger Tabak demnach ungeeignet. Dafür müsste das Nikotin aus Tabakextrakten entfernt werden. Noch besser wäre es, einen Organismus, der direkt dem Fischfutter zugesetzt werden kann, mit dem Stoffwechselweg auszustatten. Bocks Team setzt deshalb auf Rot- oder Grünalgen. Die sind billiger und können dem Futter in getrockneter Form zugesetzt werden.
Ein Beispiel für einen medizinischen Wirkstoff aus Pflanzen ist das Anti-Malariamedikament Artemisinin. Es wird aus einer kleinen einjährigen Pflanze gewonnen, die in China, Vietnam und einigen Ländern im Süden Afrikas angebaut wird, dem Einjährigen Beifuß (Artemisia annua). Die Pflanze enthält jedoch nur zwischen 0,1 und 0,4 Prozent ihrer Trockenmasse von dem Wirkstoff. Auch genetisch veränderte Pflanzen, die die Wissenschaftler in Golm entwickelt haben, enthalten nicht mehr davon. Tabak produziert jedoch viel mehr Biomasse als die kleine Beifuß-Pflanze. Damit wäre auch die Menge an Artemisinin um ein Vielfaches höher, die pro Hektar geerntet werden könnte.
Tabak ist also das Modell, an dem Ralph Bock seine Ideen testet. Dabei müssen die Forscher zunächst herausfinden, welcher Stoffwechselweg sich am besten für die Produktion der gewünschten Substanz zweckentfremden lässt und auf welche Menge einer Molekül-Zwischenstufe die Pflanze verzichten kann. „Wir dürfen den Stoffwechsel nicht zu stark stören, denn sonst wächst die Pflanze nicht mehr genug.“
Beschuss mit der Gen-Pistole
Über die Jahre haben die Wissenschaftler Unmengen an Daten über die Konzentration und Aktivität von Stoffwechselprodukten gesammelt. Sie wissen also genau, welche Menge eines Enzyms notwendig ist, damit die Pflanze eine neue Substanz produzieren kann. Deshalb verknüpfen sie zunächst die neuen Gene mit Signalstrukturen, sogenannten Promotoren, die bestimmen, wie stark das Gen aktiviert und abgelesen werden soll. Als nächstes beschichten die Forscher Nanopartikel aus Gold mit verschiedenen Varianten solcher DNA-Abschnitte und „schießen“ sie mit einer Art Druckpistole auf kleine Blattstücke. Ein kleiner Teil der Partikel bleibt innerhalb einer Pflanzenzelle stecken. Die DNA kann dann abgelesen und in die gewünschten Proteine übersetzt werden. Anschließend wachsen die genetisch veränderten Blattzellen in Nährmedien zu vollständigen Pflanzen heran.
Schließlich spielen auch technische Aspekte eine zentrale Rolle: Gibt es eine einfache und preiswerte Methode, um die Substanz anzureichern? Wenn ja, kann sie auch in großem Maßstab angewendet werden? Substanzen zu extrahieren kann langwierig und kostspielig sein. Ob es sich lohnt, hängt entscheidend davon ab, wofür das Molekül eingesetzt werden soll. „Wenn wir zum Beispiel mit hohem Aufwand nur zehn Milligramm einer Substanz aus einem Kilogramm Blätter isolieren können, eignet sie sich natürlich nicht als Fischfutterzusatz. Für ein hochwirksames Krebsmedikament kann das aber schon ausreichend sein“, sagt Ralph Bock.
Am einfachsten ist es, wenn das gewünschte Molekül in einer essbaren Pflanze produziert werden kann. „Für gesundheitsfördernde Stoffe wie Vitamine ist zum Beispiel die Tomate ideal, weil man sie roh essen kann.“ Tomaten sind reich an dem roten Farbstoff Lycopin, der Vorstufe von Vitamin A. Der in weiten Teilen Afrikas und Südasiens herrschende Vitamin-A-Mangel beeinträchtigt unter anderem die Sehkraft, erhöht die Anfälligkeit für Infektionskrankheiten und verursacht Wachstums- und Fruchtbarkeitsstörungen. „Durch eine relativ einfache enzymatische Umwandlung können wir in Tomaten aus Lycopin das Vitamin erzeugen“, so Bock. Essbare Impfstoffe wären eine weitere Anwendung für genetisch veränderte Pflanzen. Für Impfkampagnen in den Tropen müssen Impfstoffe in der Regel gekühlt transportiert und gelagert werden, sonst verlieren sie ihre Wirksamkeit. Tomaten beispielsweise könnten direkt vor Ort wachsen und auch eine gewisse Zeit gelagert werden. Auch Getreide, Nüsse oder Kürbiskerne könnten eines Tages als „Fabriken“ und natürliche Verpackungen für Impfstoffe dienen.
Reizwort Gentechnik
Denkbar ist vieles. Aber in vielen Industriestaaten ist Gentechnik für weite Teile der Bevölkerung immer noch ein Reizwort. Nach Umfragen sind 70 Prozent der Europäer gegen gentechnisch verändertes Obst, Gemüse und Getreide, die sogenannte grüne Gentechnik. Dabei stammen heute 90 Prozent der Sojaproduktion von genetisch veränderten Pflanzen. Und was kaum ein Verbraucher weiß: Bei der klassischen Züchtung werden heute meist Erbgut-verändernde Chemikalien oder Strahlung eingesetzt, die wahllos eine Vielzahl von Mutationen im Erbgut hervorrufen.
Für Arzneimittel aus transgenen Pflanzen ist die Stimmungslage genau umgekehrt: 70 Prozent der Befragten halten diese Anwendungen der grünen Gentechnik für eine gute Idee. Eigentlich ist das widersinnig, denn eine Nutzpflanze durch den Einbau oder die Veränderung eines Gens vor Insektenfraß zu schützen oder widerstandsfähiger gegen Trockenheit zu machen, gilt in der Wissenschaft einhellig als unbedenklich. Produziert man dagegen einen neuen, hochpotenten Wirkstoff in einer Pflanze, müssen die Wissenschaftler zunächst verschiedene Sicherheitsfragen klären, denn die Substanz darf keinesfalls versehentlich in die Nahrungskette gelangen. „Man sollte meinen, dass das mehr Besorgnis hervorrufen müsste. Die Bevölkerung sieht aber gerade diesen Punkt am wenigsten kritisch“, sagt Ralph Bock. Der Widerspruch in den Umfrageergebnissen spiegelt seiner Meinung nach die Prioritäten der Menschen in Europa wider. „Die Gefahren lauten Stress, Krebs, Herz-Kreislauf-Erkrankungen und Demenz – dagegen brauchen wir neue Medikamente. An Nahrungsmitteln mangelt es uns dagegen nicht. Menschen in Afrika sehen das natürlich ganz anders“, betont Bock.
Verzicht auf Freilandversuche
Freilandexperimente mit genetisch veränderten Pflanzen sind in Deutschland derzeit so gut wie unmöglich. „Wir haben das fast vollständig aufgegeben“, sagt Bock. Forscher können zwar die Freisetzung transgener Pflanzen zu Forschungszwecken beantragen, praktisch aber sind die Versuche kaum durchführbar. „Obwohl wir sehr offen mit unseren Versuchen umgegangen sind und die Öffentlichkeit dazu eingeladen haben, haben Aktivisten nachts Zäune durchschnitten und die Pflanzen zerstört.“ Das Experiment musste ein Jahr später unter kompletter Überwachung wiederholt werden. „Das hat uns 30.000 Euro gekostet. Danach haben wir beschlossen, Freisetzungsexperimente nur noch zu durchzuführen, wenn der zu erwartende Erkenntnisgewinn so groß ist, dass der Aufwand gerechtfertigt ist.“ Ralph Bock und sein Team untersuchen ihre Pflanzen daher in der Regel nur im Gewächshaus. Sind die Resultate erfolgversprechend, suchen sich die Golmer Forscher zusammen mit der Wissenstransfergesellschaft der Max-Planck-Gesellschaft einen Partner in der Industrie, der die Entwicklung zur Marktreife übernimmt.
So umweltfreundlich und nachhaltig das molekulare Farming auch klingt – könnte ihm nicht ein ähnliches Schicksal blühen, wie der Produktion von Biotreibstoffen aus Pflanzen? Die anfängliche Begeisterung für Energiepflanzen hat sich ja schnell wieder gelegt, seit die Folgen riesiger Maisfelder und Palmölplantagen für alle Welt sichtbar sind: monotone Maisfelder anstelle artenreicher Wiesen und gerodete tropische Regenwälder. Biokraftstoffe mögen für den Klimaschutz gut sein, für die Artenvielfalt sind sie eine Katastrophe. Auch Ralph Bock sieht die „Bioenergie vom Acker“ kritisch. „Im Gegensatz zu wirkstoffhaltigen Tabakpflanzen ist zum Beispiel bei Raps nur ein Bruchteil der Biomasse nutzbar: Aus den Samen werden unter gewaltigen Kosten und Umweltbelastungen nur ein paar Liter Biodiesel gewonnen. Das ist ökonomischer Wahnsinn und eine Umweltsünde zugleich.“
Geringer Platzbedarf
Im Vergleich zu den Energie- und Futterpflanzen ist der Flächenbedarf für molekulares Farming auch noch aus einem anderen Grund deutlich geringer. „Wir haben das für Artemisinin einmal durchgerechnet: Um den Weltbedarf mit unseren Tabakpflanzen zu decken, bräuchten wir eine Anbaufläche von der Größe der Stadt Boston“, erklärt Bock. Nicht sehr viel, wenn man bedenkt, dass man damit die über 200 Millionen Menschen behandeln könnte, die sich jährlich neu mit der Tropenkrankheit infizieren. Für die Erzeugung pharmazeutischer Wirkstoffe sind transgene Pflanzen also eine elegante und kostengünstige Alternative zur klassischen Pharmaproduktion, die häufig noch dem Einsatz von Erdöl beruht. Zumal es sogar möglich ist, gleich mehrere Wirkstoffe parallel in einer Pflanze herzustellen, zum Beispiel als Kombinationsimpfstoffe.
In gewisser Weise kehrt die Medizin mit dem molekularen Farming wieder zu ihren Wurzeln zurück. Schließlich behandeln Menschen ihre Leiden schon seit Jahrtausenden mit Wirkstoffen aus der Natur. Heilpflanzen waren also schon immer die Apotheke der Menschheit. Nun könnten sie es wieder werden, aber mit dem Know-how des 21. Jahrhunderts.