Röntgenaugen blicken tiefer in tödliche Krankheitserreger
Tularemie ist eine seltene, aber oft tödliche Krankheit. Sie wird durch einen der aggressivsten Krankheitserreger der Erde, das Bakterium Francisella tularensis, verursacht. Die Mikrobe, die von einer Vielzahl von Tieren und Insekten transportiert wird, kann über verschiedene Wege in den Körper eindringen und ihn angreifen, was zu unterschiedlichen Konstellationen von Symptomen und Schweregraden führt.
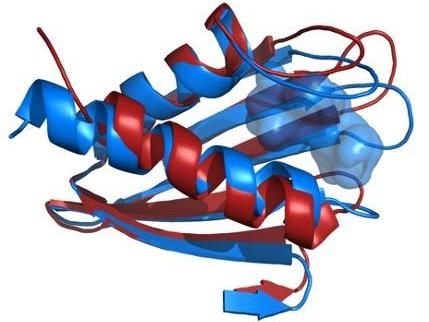
Ein Vergleich der Strukturen des Flpp3-Protein-Rückgrats, wie sie von einem Freie-Elektronen-Laser mit Röntgenstrahlung (rot) und von der NMR (blau) abgeleitet sind, zeigt einen inneren Hohlraum, der einzigartig für die NMR-Struktur ist und daher auf die Existenz von Protein-Zwischenstrukturen hindeutet.
James Zook
Die Tularemie ist nach wie vor kaum verstanden, und es gibt keinen sicheren und wirksamen Impfstoff gegen die Krankheit. Die extreme Letalität von F. tularensis und sein Potenzial zur Aerosolisierung haben ihn auch zu einem Biowaffenkandidaten gemacht, was die Dringlichkeit des Verständnisses der Krankheit und der Entwicklung wirksamer Behandlungen erhöht.
In einer neuen Studie untersuchen Forscher des Biodesign Center for Applied Structural Discovery ein Schlüsselmembranprotein, das für die ungeheure Fähigkeit des Bakteriums, den Körper zu infizieren und Krankheiten zu verursachen, verantwortlich ist. Dieser Virulenzfaktor, bekannt als Flpp3, wird mit Hilfe eines Freie-Elektronen-Laser mit Röntgenstrahlung oder XFEL, einem massiven und leistungsstarken Röntgenbeschleuniger am SLAC National Accelerator Laboratory, Stanford, in bisher nicht gekannter Detailliertheit untersucht.
Die XFEL-Technologie nutzt brillante und extrem kurze Röntgenblitze, um kristallisierte Proben von Flpp3 zu untersuchen, wodurch die detaillierte Struktur des Proteins wie nie zuvor sichtbar wird. Durch den Vergleich der durch XFEL-Experimente gewonnenen Strukturinformationen mit früheren Strukturanalysen mittels NMR haben die Forscher ein vollständigeres Modell der ausgearbeiteten Form von Flpp3 entwickelt. (Frühere Studien haben gezeigt, dass die Auswirkungen des F. tularensis-Erregers deutlich verringert werden, wenn ein für Flpp3 kodierendes Gen deaktiviert wird).
Die Wissenschaftler hoffen, diese Informationen schließlich zur Entwicklung gezielter Medikamente zu nutzen, die die Virulenz-Eigenschaften des Proteins deaktivieren und vor Tularemie schützen können. Die Fortschritte im Verständnis könnten den Wissenschaftlern auch helfen, in Zukunft einen wirksamen Impfstoff gegen die Krankheit zu entwickeln. Gegenwärtig gibt es nur abgeschwächte Lebendimpfstoffe gegen Tularemie, und das mit diesem Ansatz verbundene Infektionsrisiko und die unzureichende Immunität haben die Verwendung solcher Impfstoffe in den USA verhindert.
Der Biodesign-Forscher Dr. James Zook leitete die neue Studie zusammen mit den Professoren Petra Fromme und Abhishek Singharoy vom Biodesign Center for Applied Structural Discovery. Ihm zur Seite stehen internationale Kollegen, unter anderem Forscher von DESY, SLAC, AstraZeneca, dem Europäischen Laboratorium für Molekularbiologie in Grenoble, Frankreich.
Petra Fromme, Direktorin des Center for Applied Structural Discovery, erläutert die Bedeutung der Ergebnisse: "Diese Studie kombiniert zum ersten Mal modernste XFEL-Techniken mit NMR- und Molekülmodellierung, um den großen Konformationsraum von Flpp3 zu entschlüsseln. Die Studie entwirrt verschiedene Konformationen dieses wichtigen Proteins für die Virulenz des Bakteriums in der XFEL- und NMR-Struktur und zeigt damit die hochdynamische Natur von Flpp3. Diese Studie ist so spannend, weil sie zeigt, dass sehr unterschiedliche Konformationen koexistieren und unter physiologischen Bedingungen ineinander überführt werden".
Visualisierung der Virulenz
Mit detaillierten Strukturdaten aus der NMR und einer neuen XFEL-Analyse des Tularemie-Virulenzfaktors identifizierten die Forscher einen potenziellen Inhibitor von Flpp3. Diese Informationen wurden aus verfügbaren virtuellen Bibliotheken mit Strukturen von Arzneimittelfragmenten gewonnen. Als nächstes lieferte eine physikbasierte Modellierungsmethode, die als Molekulardynamik (MD) bekannt ist, detaillierte Informationen über die Fluktuationen und Konformationsänderungen von Atomen und Molekülen des virulenzgebundenen Proteins und half den Forschern, die Struktur und das Verhalten von Flpp3 genauer zu lesen.
"Diese Arbeit liefert mehrere atomar auflösende Strukturen eines wichtigen Virulenzfaktors aus dem Bakterium, das Tularemie verursacht", so die Biodesign-Forscherin Dr. Debra Hansen, eine Mitautorin der neuen Studie. Die identifizierten Proteinkonfigurationen werden den Forschern helfen, strukturbasiertes Design von Medikamenten zu verfolgen, die gegen die schwer fassbare Krankheit wirksam sein könnten, indem sie auf Flpp3 abzielen und es hemmen.
Wie der Co-Autor und Biodesign-Forscher Dr. Abhishek Singharoy erklärt, ist die Studie bemerkenswert, weil sie zu den ersten Untersuchungen der Protein-Konformationsflexibilität gehört, die mit serieller Femtosekunden-Röntgenkristallographie und NMR entdeckt und mit Molekulardynamik-Simulationen (MD) bestätigt wurden.
Die Ergebnisse der Gruppe erscheinen in der aktuellen Ausgabe des Cell-Press-Journals Structure.
Anhaltende Bedrohung
Die Tularemie, auch Kaninchenfieber genannt, ist eine seltene Infektionskrankheit, die nach einer Infektion mit dem Bakterium F. tularensis typischerweise Augen, Haut, Lymphknoten und Lunge befällt. Die Krankheit ist sowohl in Nordamerika als auch in vielen Teilen Europas und Asiens endemisch, obwohl Tularemie-Fälle selten sind und ausgewachsene Ausbrüche sich auf Regionen mit schlechten sanitären Verhältnissen und Unzugänglichkeit zu moderner Gesundheitsversorgung beschränken.
Tularemie befällt in erster Linie Säugetiere, insbesondere Nagetiere, Kaninchen und Hasen, obwohl sie manchmal auch Vögel, Schafe und Haustiere, einschließlich Hunde, Katzen und Hamster, infiziert.
Die Krankheit kann durch Insektenstiche und direkte Exposition gegenüber einem infizierten Tier auf den Menschen übertragen werden. Die Krankheit ist extrem ansteckend. Bereits 10 Bakterienzellen können tödlich sein, und ein einziges Bakterium kann ausreichen, um eine Infektion zu verursachen. Der Organismus kann wochenlang im Boden, im Wasser und in toten Tieren leben.
Tularemie kann wirksam behandelt werden, wenn sie früh erkannt wird, obwohl das Behandlungsregime langwierig und komplex sein kann. Die meisten mit F. tularensis infizierten Personen zeigen innerhalb von drei bis fünf Tagen Symptome, obwohl es bis zu zwei Wochen dauern kann.
Die Krankheit existiert in einer Vielzahl von Formen mit unterschiedlichen Symptomen, je nachdem, wie und wo die Bakterien in den Körper gelangen. Dazu gehören die ulzeroglanduläre Tularemie, die häufigste Form, bei der am Ort der Infektion Hautgeschwüre entstehen, geschwollene und schmerzhafte Lymphdrüsen, Fieber, Schüttelfrost, Kopfschmerzen und Erschöpfung.
Andere Formen sind Drüsen-, Augen-, Oropharyngeal-, Lungen- und Typhus-Tularemie. Unbehandelt kann eine Vielzahl schwerer Komplikationen der Krankheit auftreten, darunter Meningitis, Lungenentzündung, Reizungen im Bereich des Herzens und Knocheninfektionen.
Kristall-Methode
In der aktuellen Studie wird eine Technik, die als serielle Femtosekunden-Röntgenkristallographie bekannt ist, verwendet, um die Struktur des Flpp3-Proteins zu untersuchen. Dabei treffen kurze und brillante Röntgenausbrüche, die etwa eine Milliarde Mal heller sind als herkömmliche Röntgenstrahlen, auf einen Strahl von Kristallen, die durch den Röntgenstrahl "fliegen". Der intensive Röntgenstrahl zerstört die Kristalle, erzeugt aber vorher ein Beugungsmuster auf einem Bildschirm. Die Röntgenimpulse sind ultrakurz und dauern nur 40 Femtosekunden, so dass sie die Röntgenschäden überholen und Daten bei Raumtemperatur unter nahezu physiologischen Bedingungen gesammelt werden können. (1 fs = 10-15 Sekunden oder ein Billiardstel einer Sekunde).
Das Zusammensetzen vieler dieser Röntgenaufnahmen mit Hilfe von Computern erlaubt den Aufbau einer detaillierten, dreidimensionalen Struktur des untersuchten Proteins. Diese so genannte Methode der Beugung vor der Zerstörung wurde zuerst von Henry Chapman am Deutschen Elektronen-Synchrotron (DESY) mit dem Team der ASU unter der Leitung von John Spence und Petra Fromme und ihren Mitarbeitern entwickelt.
Die Forscher kombinierten die neuen XFEL-Strukturdaten mit ihren früheren NMR-Untersuchungen von Flpp3 und beobachteten dabei zwei verschiedene Zustände des Proteins. Die MD-Simulationen zeigten eine vorübergehende innere Hohlraumstruktur, was darauf hindeutet, dass Flpp3 eine subtile Konformationsänderung erfährt.
Dieser Ansatz öffnet die Tür zu einer gezielten Medikamentenentwicklung, die darauf abzielt, die Letalität der Tularemie zu reduzieren, und zeigt die Kraft kombinierter Technologien zur Aufklärung der Details der Proteinstruktur und -dynamik.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.