Forscherteam findet neuen Ansatz für Mittel gegen Schlafkrankheit
Röntgenlaser liefert Struktur eines Schlüsselenzyms des Erregers Trypanosoma brucei
Mit ultrahellen Röntgenblitzen hat ein Forscherteam einen möglichen Angriffspunkt für neue Medikamente gegen die Schlafkrankheit aufgespürt: Die Wissenschaftler haben die detaillierte räumliche Struktur eines lebenswichtigen Enzyms des Erregers entschlüsselt. Das Ergebnis liefert Hinweise auf einen möglichen Bauplan für einen Wirkstoff, der dieses Enzym gezielt blockiert und den Erreger somit absterben lässt, wie das Team um Christian Betzel von der Universität Hamburg, Lars Redecke von der Universität Lübeck und von DESY sowie Henry Chapman von DESY im Fachblatt „Nature Communications“ berichtet.
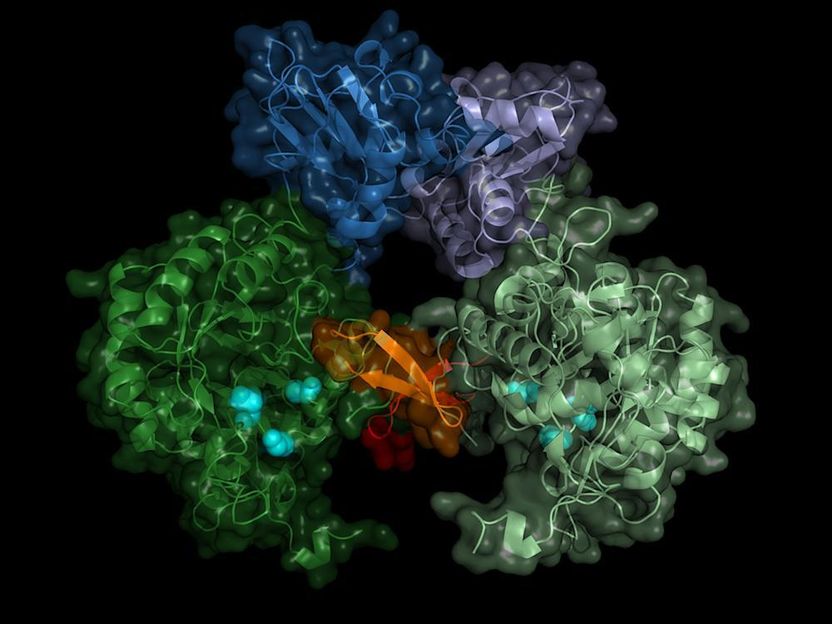
Struktur der IMP-Dehydrogenase des Parasiten: Das Enzyme bildet im aktiven Zustand Paare (Dimere), der Schalter des Enzyms (die Bateman-Region) ist in Blautönen dargestellt.
University of Lübeck/DESY, Lars Redecke
Die Schlafkrankheit wird vom Parasiten Trypanosoma brucei ausgelöst, der mit dem Stich der im südlichen Afrika heimischen Tsetse-Fliege übertragen wird. Der Parasit vermehrt sich zunächst unter der Haut, im Blut und im Lymphsystem und wandert dann in das zentrale Nervensystem. Unbehandelt gilt die Krankheit als tödlich. Durch intensive Kontrollmaßnahmen ist die Zahl der registrierten Fälle in den vergangenen Jahren drastisch gesunken. Dennoch zählen Tropenmediziner die Infektion weiter zu den bedeutendsten Tropenkrankheiten. Nach Angaben des Hamburger Bernhard-Nocht-Instituts für Tropenmedizin leben rund 65 Millionen Menschen in 36 afrikanischen Ländern südlich der Sahara im Risikogebiet. Krieg, Vertreibung und Migration könnten die Seuche immer wieder neu aufflammen lassen.
Auf der Suche nach einem möglichen Ansatzpunkt für Medikamente gegen den Erreger hatten die Forscher ein zentrales Enzym des Einzellers ins Visier genommen, die sogenannte Inosin-5'-Monophosphat-Dehydrogenase (IMPDH). „Dieses Enzym gehört zum zentralen Inventar jedes Organismus und ist ein interessantes Ziel für Medikamente, weil es den Haushalt zweier lebenswichtiger Nukleotide in der Zelle regelt: Guanosindiphosphat und Guanosintriphosphat“, sagt Redecke. „Die Zelle braucht diese Nukleotide zur Energieversorgung und zum Aufbau größerer Strukturen wie dem Erbgut. Wenn man diesen Zyklus unterbricht, stirbt die Zelle.“
Das Enzym besitzt eine Art Ein- und Ausschalter, der durch das Andocken zelleigener Moleküle aktiviert wird. Ein vielversprechender Weg ist, diesen Schalter mit einem passgenau maßgeschneiderten Molekül zu blockieren. Um so ein Blockademolekül zu konstruieren, muss die genaue räumliche Struktur des Schalters bekannt sein. Strukturbiologen können die Struktur von Biomolekülen mit Hilfe von Röntgenstrahlung bestimmen. Dazu lassen sie zunächst kleine Kristalle der Biomoleküle wachsen, die dann im Röntgenlicht charakteristische Streumuster erzeugen, aus denen sich die atomgenaue Struktur des Kristalls und seiner Bausteine, der Biomoleküle, berechnen lässt.
Dieser Weg ist oft kompliziert, denn die meisten Biomoleküle lassen sich nur schwer kristallisieren. Gelingt die Zucht solcher Kristalle, sind sie gegenüber der energiereichen Röntgenstrahlung meist sehr empfindlich und werden schnell zerstört. „Es sind zwar bereits die Strukturen zahlreicher IMP-Dehydrogenasen bekannt, bei jener des Parasiten Trypanosoma brucei war die Kristallzucht bislang jedoch nicht erfolgreich“, berichtet Betzel, der auch im Exzellenzcluster CUI: Advanced Imaging of Matter von Universität Hamburg und DESY forscht.
Das Team wählte daher einen alternativen Weg: Die Gruppe von Ko-Autor Michael Duszenko an der Universität Tübingen hat bestimmte Insektenzellen dazu gebracht, Biomoleküle in ihrem Inneren zu kristallisieren. Mit Hilfe dieser sogenannten In-cellulo-Kristallisation hatte dasselbe Team bereits ein anderes Enzym des Schlafkrankheit-Erregers entschlüsselt, Cathepsin B, das ebenfalls einen potenziellen Angriffspunkt für Medikamente darstellt. Tatsächlich produzierten die veränderten Insektenzellen auch Kristalle der nun untersuchten Dehydrogenase. Diese winzigen, nadelförmigen Kristalle wurden rund 5 tausendstel Millimeter (Mikrometer) dick und bis zu 70 Mikrometer lang, so dass sie aus den produzierenden Zellen herausstachen.
Die In-cellulo-Kristalle sind so klein, dass sehr helles Röntgenlicht nötig ist, um sie zu analysieren. Denn je größer ein Kristall ist, desto mehr Atome hat er, die Röntgenlicht streuen, desto besser wird das Streubild. Die Forscher nutzten daher zur Analyse den Röntgenlaser LCLS am US-Forschungszentrum SLAC in Kalifornien. „Röntgenlaser erzeugen extrem intensive Blitze“, erläutert Chapman, der Leitender Wissenschaftler bei DESY am Center for Free-Electron Laser Science CFEL und einer der Sprecher des Exzellenzclusters CUI: Advanced Imaging of Matter ist. „Zwar explodieren die empfindlichen Kristalle sofort, erzeugen zuvor aber noch ein Streubild, aus dem sich die Struktur gewinnen lässt.“ Diese Methode heißt serielle Femtosekunden-Kristallographie (SFX), und viele der Ko-Autoren der aktuellen Studie waren an der Entwicklung dieser Technik beteiligt, die vom US-Fachjournal „Science“ als einer der zehn wichtigsten wissenschaftlichen Durchbrüche des Jahres 2013 eingestuft worden war.
Das Team zeichnete die Streubilder von mehr als 22.000 Mikrokristallen auf und konnte daraus die räumliche Struktur des Enzyms mit einer Genauigkeit von 0,28 millionstel Millimeter (Nanometer) genau berechnen – das entspricht in etwa dem Durchmesser eines Aluminium-Atoms. „Das Ergebnis zeigt nicht nur die genaue Struktur des Enzym-Schalters, der Bateman-Region, sondern auch, mit welchen Molekülen die Zelle das Enzym schaltet und wie diese sogenannten Ko-Faktoren an dem Enzymschalter andocken“, berichtet Karol Nass von DESY, der an dieser Studie im Rahmen seiner Doktorarbeit gearbeitet hat. Nass forscht heute am Paul-Scherrer-Institut in der Schweiz und ist zusammen mit Redecke Hauptautor der Veröffentlichung.
Der Schalter wird den Ergebnissen zufolge von den Molekülen Adenosintriphosphat (ATP) und Guanosinmonophosphat (GMP) bedient. „Der Vorteil unserer Methode ist nicht nur, dass wir das Enzym bei Raumtemperatur untersuchen können, also bei der Temperatur, für die das Enzym gemacht ist, sondern auch, dass bei der In-cellulo-Kristallisation die natürlichen Ko-Faktoren an das Enzym gebunden werden“, sagt Betzel. Die Daten könnten dem Forscher zufolge nun einen Ansatz für eine Blockade der Parasiten-Dehydrogenase liefern. „Es wäre beispielsweise denkbar, eine Art Spange zu konstruieren, die sich über die Andockstellen beider Ko-Faktoren legt.“
Eine Herausforderung bleibt dabei jedoch noch, den Dehydrogenase-Blocker so spezifisch zu konstruieren, dass er das Parasiten-Enzym blockiert, aber nicht das menscheneigene. Wenn dies gelingt, könnte die Methode möglicherweise auch auf andere Erreger ausgedehnt werden, erläutert Betzel. „Andere Parasiten haben einen sehr ähnlichen Aufbau, eventuell ließen sich auch die über die jeweilige IMP-Dehydrogenase angreifen. Das Enzym ist ein sehr interessantes Ziel für Medikamente, etwa auch gegen den Fuchsbandwurm oder den Erreger der Elephantiasis.“
An der Untersuchung waren die Universitäten Hamburg, Lübeck und Tübingen, die russische Akademie der Wissenschaften, die Arizona State University, das Lawrence Livermore National Laboratory in den USA, das Max-Planck-Institut für medizinische Forschung, das US-Forschungszentrum SLAC, die Universität Göteborg und DESY beteiligt.






















































