Magenkrebs im Visier
Neuer Ansatz für eine selektive Chemotherapie
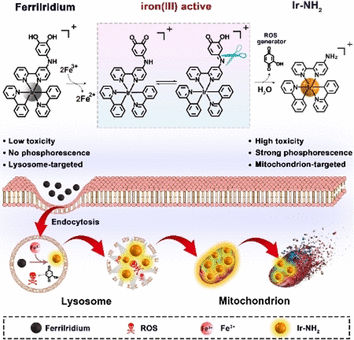
Ein neuartiger Wirkstoff namens „FerriIridium“ soll gleichzeitig Therapie und Diagnostik von Magenkrebs möglich machen. Die zunächst wenig wirksame Vorstufe („Prodrug“) auf Basis einer iridiumhaltigen Verbindung wird erst innerhalb der Tumorzellen selektiv durch deren erhöhten Gehalt an Eisenionen aktiviert, wie Wissenschaftler in der Zeitschrift Angewandte Chemie erläutern. So werden unerwünschte Nebenwirkungen verringert.
© Wiley-VCH
Zellen transportieren Stoffe aus dem extrazellulären Raum in ihr Inneres, indem sie winzige Bereiche ihre Membran nach innen stülpen und abschnüren (Endocytose). Auf diese Weise gelangt auch FerriIridium ins Zellinnere. Die entstehenden Vesikel verschmelzen dann mit sogenannten Lysosomen, Zellorganellen mit saurem Milieu, die dreiwertige Eisenionen Fe(III) und Enzyme enthalten, um Fremdstoffe und nicht mehr benötigte zelleigene Stoffe in ihre Bestandteile zu zerlegen. In Magenkrebszellen ist die Fe(III)-Konzentration der Lysosomen deutlich erhöht.
Das machen sich die Wissenschaftler um Yu Chen und Hui Chao von der Sun Yat-Sen University, Guangzhou, und der Hunan University of Science and Technology in Xiangtan (China) zunutze: Sie statteten FerriIridium mit einer speziellen funktionellen Gruppe (m-Iminocatechol-Gruppe) aus, die selektiv Fe(III) bindet und dabei oxidiert wird, während die Eisenionen zu Fe(II) reduziert werden. Unter den sauren Bedingungen der Lysosomen wird FerriIridium daraufhin in zwei Bestandteile gespalten: einen Iridium-Komplex und ein Benzochinon-Derivat.
Diese Reaktionsfolge hat einen dreifachen Effekt: Erstens können Fe(II)-Ionen eine Reaktion katalysieren, bei der hochreaktive Hydroxyl-Radikale entstehen. Zweitens wirken Benzochinone stark oxidierend. Mit bestimmten zellulären Substanzen, wie etwa NADPH, entstehen Hydroxychinone, die mit Sauerstoff reagieren, wobei radikalische Sauerstoffspezies entstehen sowie Wasserstoffperoxid, das wiederum mit Fe(II) zu Hydroxyl-Radikalen reagieren kann. Zudem können Benzochinon-Verbindungen die zelluläre Atmungskette stören. Die Lysosomen werden durch die Radikale zerstört und ihr Inhalt freigesetzt. Drittens erhöht die Spaltung sowohl die Phosphoreszenz als auch die Toxizität des Iridium-Komplexes drastisch. Anhand der Phosphoreszenz lässt sich der Tumor diagnostizieren. Vor allem aber wird der toxische Iridium-Komplex von Mitochondrien aufgenommen, den zellulären „Kraftwerken“, die der Wirkstoff von innen heraus zerstört, indem er ihr Membranpotential kollabieren lässt. Gemeinsam führen diese Effekte letztlich zu einem Absterben der Magenkrebszellen und einem Schrumpfen der Tumore, wie Versuche an Zelllinien sowie Tumormäusen belegten.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.





















































