MINFLUX-Nanoskopie sieht Zellen molekular scharf
Fluoreszenzmikroskopie mit molekularer Trennschärfe nun auch für die Lebenswissenschaften
Vor drei Jahren stellten der Göttinger Nobelpreisträger Stefan Hell und sein Team die MINFLUX-Nanoskopie vor. Mit ihr war es erstmals möglich, fluoreszierende Moleküle mit Licht getrennt sichtbar zu machen, die nur ein paar Nanometer (millionstel Millimeter) voneinander entfernt sind – die Technik ist also hundertmal schärfer als die herkömmliche Lichtmikroskopie. Schärfer geht es nicht. Jetzt haben die Max-Planck-Forscher eine neue Entwicklungsstufe dieser Technik präsentiert: MINFLUX erreicht diese Auflösung nun auch in Zellen, und das mehrfarbig und in 3D. Damit lässt sich die MINFLUX-Nanoskopie auf vielfältige biologische Fragestellungen anwenden.
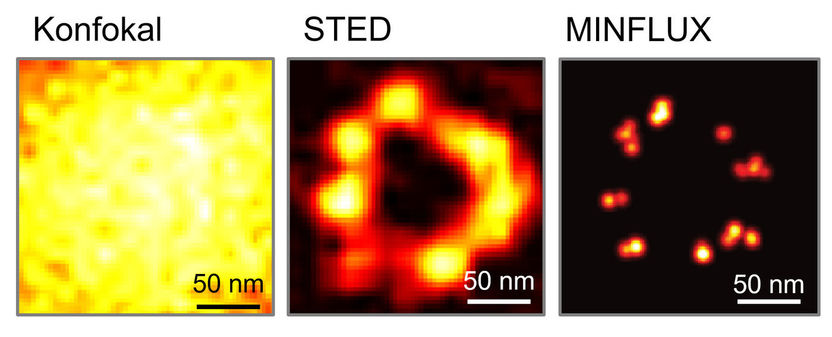
Der Vergleich dokumentiert die epochalen Auflösungs-Durchbrüche in der Fluoreszenzmikroskopie: Die von Stefan Hell und Mitarbeitern entwickelte STED-Mikroskopie erreichte bereits vor über zehn Jahren eine etwa 10 Mal höhere Auflösung als die weitverbreitete Konfokal-Mikroskopie. Mit MINFLUX steigerten sie nun die Detailschärfe noch einmal um das 10-Fache, also insgesamt 100-fach und damit bis in den Bereich weniger Nanometer.
© Stefan Hell / Max-Planck-Institut für biophysikalische Chemie
Es war ein großes Versprechen für die biologische Forschung, das Hell gab, als er und sein Team im Jahr 2016 MINFLUX vorgestellt hatten: Er sei davon überzeugt, dass die Methode das Zeug dazu habe, eines der mächtigsten Werkzeuge der Zellbiologie zu werden, sagte der Physiker vom Göttinger Max-Planck-Institut (MPI) für biophysikalische Chemie damals. „Mit diesem Verfahren wird es möglich sein, Zellen molekular zu kartografieren.“
Für MINFLUX hatte Hell die Stärken der beiden bis dato hochauflösendsten Fluoreszenz-Nanoskopie-Techniken zusammengeführt: PALM/STORM und die von ihm selbst entwickelte STED-Mikroskopie, für die er 2014 den Nobelpreis für Chemie erhalten hatte. MINFLUX erreichte erstmals eine Trennschärfe von wenigen Nanometern und war auch bis zu hundertmal schneller im Verfolgen sich in der Zelle bewegender Moleküle. Allerdings war MINFLUX damals nur für künstliche Testobjekte gezeigt worden und noch nicht für die Untersuchung von (lebenden) Zellen einsetzbar.
Die aktuelle Veröffentlichung mit den Erstautoren Klaus Gwosch, Jasmin Pape und Francisco Balzarotti löst nun dieses Versprechen ein und zeigt das ganze Potential der Methode. „Wir haben MINFLUX so weit entwickelt, dass wir fluoreszierende Moleküle in Zellen mit maximaler, molekularer Auflösung, in zwei Farben und dreidimensional sichtbar machen können“, fasst Jasmin Pape zusammen. „Damit erfüllt MINFLUX bereits heute viele Anforderungen, um Moleküle und Prozesse in lebenden Zellen molekular scharf abzubilden und zu untersuchen.“
MINFLUX nutzt einen Donut-förmigen Laserstrahl mit einer Intensitäts-Nullstelle in der Mitte, um einzelne fluoreszierende Moleküle zum Leuchten zu bringen. Aus der Stärke der Fluoreszenz lässt sich die ungefähre Position des Moleküls relativ zur Donutmitte bestimmen. Anschließend bewegt das Mikroskop den Donut so, dass sich die Intensitäts-Nullstelle näher am Molekül befindet. Weil die Position der Nullstelle bekannt ist, ist somit auch die Molekülposition genauer bestimmt – und das mit vergleichsweise wenigen Fluoreszenzphotonen. Die Wissenschaftler optimierten diesen Prozess, bis er auf ein bis drei Nanometer exakte Ergebnisse lieferte. MINFLUX ist nun auch für größere Proben einsetzbar, wie sie typischerweise unter dem Mikroskop von Biologen liegen, wenn sie lebende Zellen analysieren.
Außerdem nutzt MINFLUX jetzt eine dreidimensionale Donut-Intensitäts-Nullstelle, um Molekülverteilungen auch in allen Raumrichtungen – also in 3D – molekular aufzulösen. Mit dem neuesten Versuchsaufbau können die Forscher noch dazu die Verteilung zweier unterschiedlich markierter Molekülarten zeitgleich beobachten.
„MINFLUX ist nun bereit für zellbiologische Fragestellungen. Trotz der neuen, fundamentalen Weiterentwicklung besteht immer noch Potenzial, um MINFLUX weiter zu verbessern: Sowohl die Aufnahmezeit als auch störende Hintergrundsignale lassen sich in Zukunft weiter reduzieren, was die Methode noch weiter verbessern wird. Es wird kräftig weitergehen“, so die Max-Planck-Forscher.