Erstes robustes Zellkulturmodell für das Hepatitis-E-Virus
Eine Mutation schaltet bei der Virusvermehrung den Turbo ein. Warum das für die Forschung ein Segen ist.

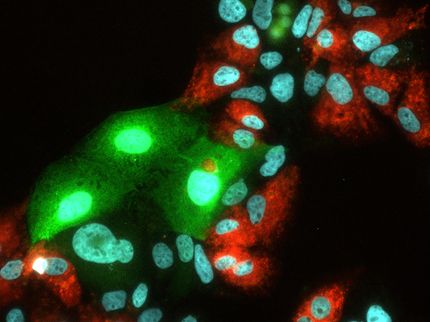
Eike Steinmann, Daniel Todt und Martina Friesland (von links) stellen der wissenschaftlichen Community ein Zellmodell und umfassende Daten zum Hepatitis-E-Virus zur Verfügung.
© RUB, Marquard; Avista Wahid
Obwohl Hepatitis E jedes Jahr über drei Millionen Infektionen und rund 70.000 Todesfälle verursacht, ist das Virus bisher wenig untersucht. Das könnte sich ändern, denn ein Forschungsteam aus Bochum und Hannover hat ein robustes und verbessertes Zellmodell des Erregers entwickelt. Es produziert etwa 100-mal mehr infektiöse Viruspartikel als bisherige Modelle. „Das macht das Virus jetzt wissenschaftlich erforschbar“, sagt Prof. Dr. Eike Steinmann, Inhaber des Lehrstuhls Molekulare und Medizinische Virologie an der Ruhr-Universität Bochum (RUB).
Mutation führt zu verstärkter Vermehrung
Dass das Hepatitis-E-Virus bisher wenig erforscht ist, liegt nicht zuletzt daran, dass es kein robustes Zellkulturmodell gab. „Die Anzahl der in bisherigen Modellen produzierten infektiösen Viruspartikel war einfach zu gering, um reproduzierbare Ergebnisse zu generieren“, erklärt der Bochumer Autor Dr. Daniel Todt.
Das Forschungsteam beschäftigte sich in vorangegangenen Studien mit Viruspopulationen, die durch genetische Mutationen des Virus in Patienten entstehen, und fand dabei eine bestimmte genetische Veränderung, die zu einer erheblich stärkeren Vermehrung des Erregers führt. Die Forscher fügten diese Mutation in die bisher genutzten Zelllinien ein und konnten so die Produktion neuer Viruspartikel um das Fünf- bis Zehnfache steigern.
In ihrer aktuellen Arbeit optimierten sie die Zellkulturbedingungen durch Zugaben spezieller Nährmedien und die Nutzung verschiedener Leberzelllinien. Diese Maßnahmen führten zu rund 100-mal mehr infektiösen Viruspartikeln als bisher publiziert.
Aufwändige Tests zeigen, dass das Modell funktioniert
Um zu überprüfen, ob das neue Zellkulturmodell sich für die Erforschung des Virus eignet, machten die Forscher verschiedene Experimente. So testeten sie, ob umhüllte und nackte Viren gleichermaßen entstehen. „Beide Varianten des Virus kommen bei Patienten vor“, erklärt Autorin Martina Friesland vom Institut für Experimentelle Virologie des Twincore-Zentrums für Experimentelle und Klinische Infektionsforschung in Hannover. „Sie sind aber für verschiedene Infektionswege verantwortlich. Während das umhüllte Virus bei Blut-Blutkontakt, wie zum Beispiel Transfusionen, übertragen wird, wird das nackte Virus über den Stuhl ausgeschieden und sorgt für die Ansteckung zum Beispiel durch kontaminiertes Trinkwasser.“ Beide Varianten können jetzt mit dem neuen Zellkulturmodell studiert werden.
Die Forscher hatten in einer vorangegangenen Studie nachgewiesen, dass die Mutation bei allen verschiedenen Hepatitis-E-Viren (HEV) zu einer verstärkten Vermehrung führt, und dass das auch bei verschiedenen in der Forschung verwendeten Leberzelllinien so ist. In der aktuellen Untersuchung konnten sie das Modell nochmals optimieren. „Wir haben also Erkenntnisse aus der Klinik genutzt, um ein präklinisches in-vitro-Modell zu verbessern“, erklärt Daniel Todt. Der Effekt der stärkeren Vermehrung zeigt sich auch bei gesunden menschlichen Leberzellen, ebenso wie im Tiermodell. Hier waren über mehr als einen Monat hinweg Viruspartikel sowohl im Blut als auch im Kot von Nagern nachweisbar. „Bei bisherigen Modellen gelang der Nachweis immer nur im Stuhl, weil die Anzahl der produzierten Viruspartikel zu niedrig war“, erläutert Daniel Todt. „Wir können jetzt infektiöse Viren in fast unbegrenzter Menge für die Forschung produzieren und müssen nicht auf Virusisolate aus Patienten zurückgreifen.“
Komplettes Detailverständnis
Da sie zum ersten Mal aus gesundem Lebergewebe isolierte Zellen reproduzierbar mit HEV infizieren konnten, unternahmen die Forscher eine Tiefensequenzierung: Sie untersuchten die gesamte genetische Information des Virus zu verschiedenen Zeitpunkten der Infektion mit und ohne Einfluss von Medikamenten. Außerdem analysierten sie die veränderte Expression verschiedener Proteine befallener Leberzellen als Reaktion auf die Infektion sowohl unter dem Einfluss von Medikamenten als auch ohne Wirkstoffeinfluss. „Wir wollten wissen, wie die Zelle auf die Infektion reagiert“, so Daniel Todt. „Es ging uns um ein komplettes Detailverständnis“, unterstreicht Eike Steinmann. „Nur das wird es uns in Zukunft erlauben, Gene, die für den Infektionsverlauf besonders wichtig sind, zu identifizieren und als mögliche Ziele für Therapieansätze ins Auge zu fassen.“ Den Datensatz, sowie das optimierte Protokoll stellen die Forscher öffentlich zur Verfügung, um der gesamten wissenschaftlichen Community die Möglichkeit zu geben, mit dem Modell und den bisherigen Erkenntnissen weiterzuarbeiten.