Humane Papillomviren programmieren ihre Wirtszellen um und begünstigen so die Hautkrebsentstehung
Humane Papillomviren sind nicht nur ursächlich für genitale Krebsarten und Kopf-Hals-Tumoren, sondern verursachen auch den weißen Hautkrebs. Immungeschwächte Menschen, beispielsweise Organtransplantat-Empfänger, sind hierbei besonders anfällig für die Entstehung solcher Tumoren. Die zellulären Vorgänge, die zur Tumorentwicklung führen, sind bis heute nur unvollständig verstanden. Die Arbeitsgruppe um Prof. Baki Akgül vom Institut für Virologie der Uniklinik Köln konnte nun im Rahmen eines von der Wilhelm Sander-Stiftung geförderten Forschungsprojektes bislang unbekannte Mechanismen aufdecken, über die das Virus Einfluss auf infizierte Zellen nimmt.
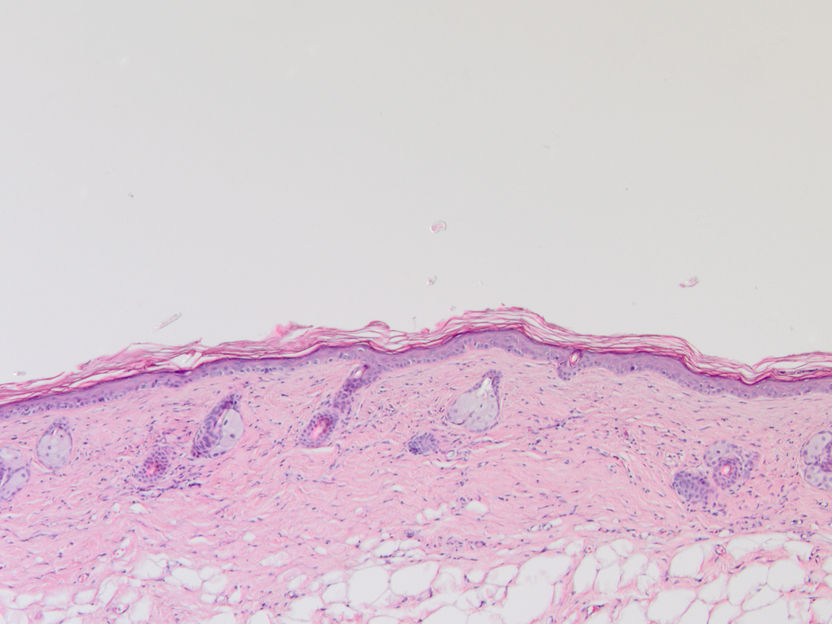
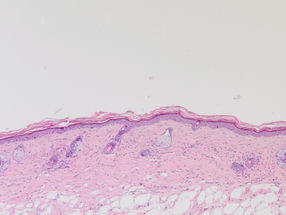
Abb. 1: Histologische Färbung gesunder Maushaut. Vergrößerung 100 x
© Baki Akgül, Köln
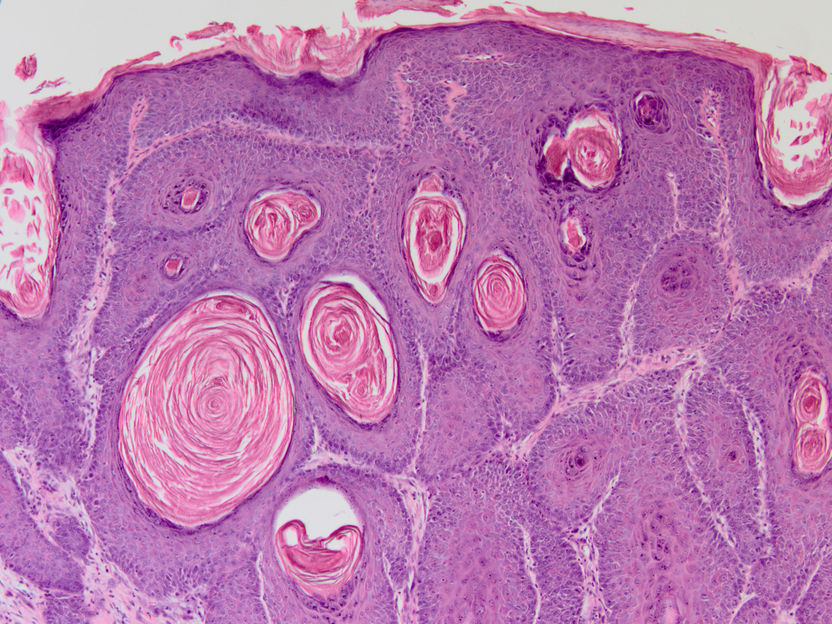
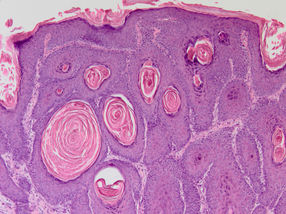
Abb. 2: Histologische Färbung eines HPV8-E7 induzierten Maushaut-Tumors. Vergrößerung 100 x
© Baki Akgül, Köln
Humane Papillomviren (HPV) sind kleine Erreger, die sowohl die menschliche Schleimhaut, als auch verhornende Haut infizieren können. Dies kann sowohl zu gutartigen als auch bösartigen Veränderungen im infizierten Gewebe führen. Des Weiteren werden die Viren in verschiedene Untergruppen eingeteilt. Für bestimmte Krebsarten, z. B. Gebärmutterhals- und Tonsillenkrebs (Mandelkrebs), ist der Zusammenhang zwischen einer Infektion mit HPV der sogenannten alpha-Gruppe bewiesen. Viren der sogenannten beta-HPV-Gruppe sind sehr weit verbreitet und besiedeln die menschliche Haut schon in den ersten Wochen nach der Geburt. Beta-HPV werden durch das Immunsystem effizient in Schach gehalten, sodass die Virusvermehrung auf sehr niedrigem Niveau stattfindet und zu keinen klinischen Auswirkungen führt. In der Bevölkerung ist daher das Bewusstsein dafür, dass auch diese Untergruppe für die Entstehung von Hautkrebs verantwortlich sein kann, nicht sehr stark ausgeprägt. Insbesondere bei Menschen, die ein Organtransplantat erhalten haben, und bei denen daher das Immunsystem dauerhaft unterdrückt werden muss, um eine Abstoßung des Spenderorgans zu verhindern, kommt es zu einer abnormalen Vermehrung von beta-HPV in der Haut. Dies begünstigt die Bildung von Hautkrebsvorstufen und somit letztlich auch die Entstehung von weißem Hautkrebs. Dies betrifft auch Personen, die an einer chronischen Immunschwäche leiden. Auf welche Weise die Viren die Krebsentstehung begünstigen, ist bis heute noch nicht im Detail verstanden. Im Rahmen eines von der Wilhelm Sander-Stiftung geförderten Forschungsprojektes konnte die Arbeitsgruppe von Prof. Dr. rer. nat. Baki Akgül vom Institut für Virologie der Uniklinik Köln zeigen, dass HPV mittels eines bislang unbekannten Mechanismus Einfluss auf infizierte Zellen nimmt und sowohl die Herstellung zellulärer Proteine als auch deren Stabilität beeinflusst.
Das Forscherteam um Baki Akgül nutzte für seine Untersuchungen 2D-Zell-Kultursysteme, 3D-Hautkulturmodelle und transgene Mäuse und konnte so zeigen, dass allein das Vorhandensein des viralen Proteins E7 ausreicht, um infizierte Hautstammzellen vermehrt in Krebsstammzellen umzuprogrammieren. So konnten die Wissenschaftler molekularen Mechanismen aufdecken, durch die Virus-positive Zellen ihren Gewebeverband verlassen, in andere Gewebeschichten einwandern und krebszellartiges Verhalten entwickeln. Diesem Vorgang der Zellinvasion liegt einerseits die Fähigkeit des Proteins E7 zu Grunde, Zell-Zell-Kontakte von infizierten Hautzellen zu schwächen, was die Grundvoraussetzung für eine Ablösung aus dem Gewebeverband ist. Andererseits zeigte die Arbeitsgruppe eine Interaktion zwischen einer Familie von Zelloberflächenproteinen, den sogenannten Integrinen, und dem Bindegewebsprotein Fibronektin. Es gelang den Forschern nachzuweisen, dass diese gegenseitige Einflussnahme ebenfalls begünstigend für die Entstehung von Krebs ist.
Des Weiteren konnten die Wissenschaftler zeigen, dass das Virus Einfluss auf die Genexpression infizierter Zellen nimmt. Es gelang ihnen zudem, einen völlig neuen Mechanismus aufzudecken, über den das Virus die Stabilität von wichtigen zellulären Proteinen beeinträchtigt, die bei der Zellteilung und der DNA-Reparatur eine tragende Rolle spielen. So konnten sie erstmalig eine Kooperation der viralen Proteine E6 und E7 belegen, welche offenbar gemeinsam Einfluss auf die Stabilität wichtiger zellulärer Regulatoren über den Protein-Abbauprozesses der sogenannten Autophagie nehmen. Die Klärung weiterer tumorigener Mechanismen sind Gegenstand fortlaufender Forschung, ebenfalls gefördert durch die Wilhelm Sander-Stiftung. Diese Arbeiten sind eine zwingende Voraussetzung, Therapien und Impfansätze für HPV-verursachten weißen Hautkrebs zu entwickeln.