RNA-Modifikation: Umbau unter Druck
LMU-Wissenschaftler haben eine neuartige Modifikation gefunden, mit der Bakterien ihre RNA markieren. Sie entsteht offenbar nur unter Stress und kann von der Zelle schnell repariert werden.
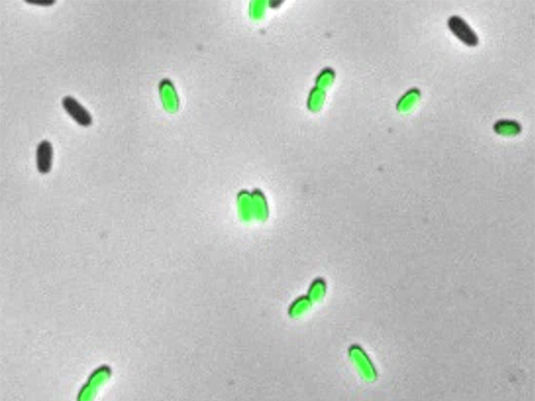
Das Bakterium E. coli modifiziert unter Stress seine RNA.
AG Jung
Die Ribonukleinsäure (RNA) ist chemisch dem Erbträgermolekül DNA ähnlich und wesentlich daran beteiligt, genetische Information in der Zelle umzusetzen – einem zentralen Prozess des Lebens also. Wie DNA ist auch RNA aus vier verschiedenen Bausteinen aufgebaut, sogenannten Nukleinbasen, die durch Zucker und Phosphatbrücken verknüpft sind. Doch alle Organismen modifizieren ihre RNA-Bausteine noch zusätzlich, um deren Funktion zu regulieren. Die LMU-Wissenschaftlerin Stefanie Kellner, Leiterin einer Emmy Noether-Nachwuchsgruppe am Department Chemie, hat nun in Kooperation mit Kirsten Jung, Inhaberin des Lehrstuhls für Mikrobiologie an der LMU, eine solche – biochemisch recht ungewöhnliche – Modifikation bei Bakterien gefunden. Sie entsteht, wenn die Mikroorganismen unter Stress geraten, und kann in Erholungsphasen schnell wieder rückgängig gemacht werden.
Sowohl DNA als auch RNA können durch sogenannte Methylierungen – das Übertragen von Methylgruppen auf die Nukleinbasen – modifiziert werden. Darüber hinaus modifizieren Bakterien ihre RNA durch den Einbau von Schwefelatomen, um die Bildung von Proteinen zu regulieren. Im Bakterium Escherichia coli haben die Wissenschaftler nun eine bisher unbekannte Art der Modifikation gefunden: „Bei unseren Bakterien wird die Methylgruppe an ein Schwefelatom im RNA-Baustein Cytidin angeheftet“, sagt Kellner, in der Regel ist sie an ein Stickstoffatom gebunden. „Durch die Kopplung an Schwefel entsteht ein sogenanntes 2-Methylthiocytidin oder kurz ms2C.“
Weitere Untersuchungen zeigten, dass ms2C entsteht, wenn die Bakterien unter Stress gesetzt werden, etwa aufgrund bestimmter chemischer Stoffe oder Antibiotika in ihrer Umgebung. Durch die stressbedingte Modifikation ist die Proteinbildung gestört. Das Bakterium geht an dem Schaden aber nicht zugrunde: Es besitzt ein Enzym, das die Methylierung rückgängig machen kann, indem es die Methylgruppe abschneidet.
Diesen Reparaturmechanismus haben die Wissenschaftler nun mithilfe einer speziellen Methode, die als NAIL-MS bezeichnet wird, erstmals direkt nachgewiesen. Dabei werden Isotopenmarkierung und hoch sensitive Massenspektrometrie kombiniert, um das Schicksal der stressgeschädigten RNA in der Erholungsphase nach dem Stress weiter zu verfolgen. „Auf diese Weise konnten wir in der lebenden Zelle zeigen, dass geschädigte RNA nicht abgebaut, sondern durch das Entfernen der Methylgruppe repariert wird“, sagt Kellner.
Da die Reparatur sehr schnell erfolgt – innerhalb von ein bis zwei Stunden werden die Methylgruppen beseitigt – vermuten die Wissenschaftler, dass die Zelle auf den Schaden „vorbereitet“ ist. Möglicherweise dienen die schwefelhaltigen RNA-Bausteine dazu, durch den Stress entstandene Methylgruppen abzufangen, bevor sie an DNA oder andere Proteine binden und diese schädigen könnten. Da RNA in der Zelle sehr häufig ist, könnte dies nach Ansicht der Wissenschaftler ein effektiver Entgiftungsmechanismus sein.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte
Granne
Tympanometrie
Celesio mit knappen Gewinn 2009
Kegelhütiger_Knollenblätterpilz