Parkinson-Proteine haben molekulare Leibgarde
Helferproteine in menschlichen Zellen gehen eine dynamische Verbindung mit dem Parkinson-Protein α-Synuclein ein. Wird die Beziehung zu diesen «Leibwächtern» gestört, kommt es zu Zellschäden und zur Entstehung der für Parkinson typischen Lewy-Körperchen.
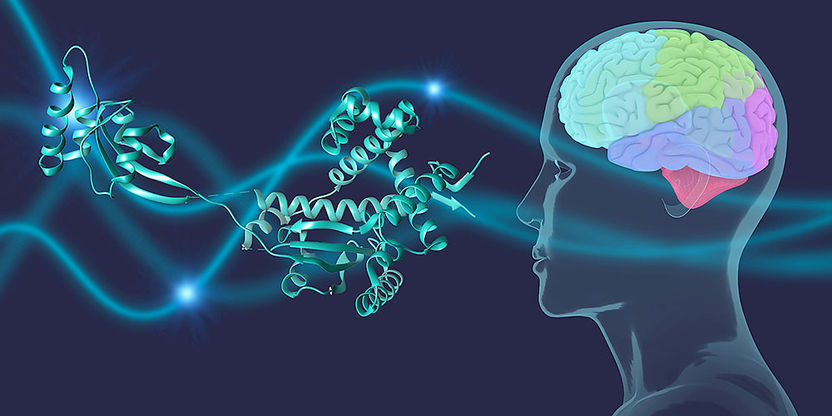
Chaperone schützen das Parkinson-Protein α-Synuclein im Gehirn.
University of Basel, Biozentrum
Die Parkinson-Krankheit gehört zu den häufigsten neurodegenerativen Erkrankungen. In der Schweiz leben etwa 15’000 Betroffene. Aufgrund der weltweit steigenden Lebenserwartung, rechnet man mit einem rasanten Anstieg von Parkinson-Fällen. Die Ursachen von Parkinson, bei dem es zu einem fortschreitenden Absterben von Nervenzellen im Gehirn kommt, sind bis heute nicht genau bekannt. Daher ist die Entwicklung wirkungsvoller Therapien umso schwieriger.
Einig ist man sich darüber, dass das Protein α-Synuclein eine Rolle bei der Entstehung von Parkinson spielt. Forscher um den Strukturbiologen Prof. Sebastian Hiller haben nun herausgefunden, dass Helferproteine, sogenannte Chaperone, wie persönliche Leibwächter dieses Protein in menschlichen Zellen ständig bewachen. Können die Chaperone ihr Aufgabe nicht wahrnehmen, zeigt α-Synuclein seine negativen Seiten und verursacht gravierende Schäden in der Zelle.
Molekulare Leibwächter interagieren mit α-Synuclein
In menschlichen Zellen gibt es etwa dreissig bis vierzig solcher Chaperone, die potenziell mit α-Synuclein interagieren können. Die Wissenschaftler haben systematisch auf atomarer Ebene untersucht, an welcher Stelle die molekularen Leibwächter mit dem α-Synuclein wechselwirken.
«Wir haben mithilfe hochmoderner NMR-Spektrometer ein spezifisches Muster entdeckt, das uns zeigt, wo genau die Chaperone mit α-Synuclein in Kontakt treten», erklärt Hiller. «Dabei handelt es sich nicht um eine feste, starre Verbindung, sondern um dynamische, ständig wechselnde Beziehungen.» In gesunden Zellen wird das Parkinson-Protein stets von Chaperonen begleitet. So bleibt es transportfähig und zudem besteht ein Pool, der den Bedarf an funktionstüchtigen α-Synuclein-Proteinen deckt.
Zellschäden durch Beziehungsprobleme
Schwerwiegende Folgen hat es, wenn die Chaperone ihrer Leibwächter-Funktion nicht mehr nachkommen können. Chemische Veränderungen am α-Synuclein beispielsweise, wie sie auch bei Parkinson zu beobachten sind, stören die Interaktion mit den Chaperonen. Dies führt dazu, dass sich «unbegleitete» α-Synuclein-Proteine an der Membran von Mitochondrien, den Zellkraftwerken, ansammeln und diese nach und nach zerstören. Wie erst kürzlich gezeigt wurde, bestehen die für Parkinson typischen Lewy-Körperchen zu grossen Teilen aus solchen Membrantrümmern von Mitochondrien und α-Synuclein.
Neues Aufgabengebiet von Chaperonen entdeckt
«Mit unserer Arbeit rütteln wir an dem Paradigma, dass Chaperone nur dazu da sind, um anderen Proteinen dabei zu helfen, ihre richtige Form zu finden», so Hiller. «Chaperone sind aber weit mehr als Faltungshelfer. Sie kontrollieren zelluläre Prozesse, indem sie mit einer Vielzahl von Proteinen flexible Beziehungen eingehen und sie wie ein Schatten begleiten.»
Das Verständnis über die molekularen Interaktionen sowie das Verhältnis der beteiligten Partner liefert wichtige Impulse zur Behandlung von Parkinson. Zukünftig sollten auch die Chaperone sowie die Aufrechterhaltung ihrer Funktionsfähigkeit bei der Entwicklung von Therapien in Betracht gezogen werden.
Originalveröffentlichung
Björn M. Burmann, Juan A. Gerez, Irena Matečko-Burmann, Silvia Campioni, Pratibha Kumari, Dhiman Ghosh, Adam Mazur, Emelie E. Aspholm, Darius Šulskis, Magdalena Wawrzyniuk, Thomas Bock, Alexander Schmidt, Stefan G.D. Rüdiger, Roland Riek, Sebastian Hiller; "α-Synuclein regulation by chaperones in mammalian cells"; Nature; 2019
Meistgelesene News
Originalveröffentlichung
Björn M. Burmann, Juan A. Gerez, Irena Matečko-Burmann, Silvia Campioni, Pratibha Kumari, Dhiman Ghosh, Adam Mazur, Emelie E. Aspholm, Darius Šulskis, Magdalena Wawrzyniuk, Thomas Bock, Alexander Schmidt, Stefan G.D. Rüdiger, Roland Riek, Sebastian Hiller; "α-Synuclein regulation by chaperones in mammalian cells"; Nature; 2019
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte
Bereits über 400 EHEC-Neuerkrankungen 2012 - Nur wenige Lebensmittelproduzenten lassen regelmäßige Laborkontrollen durchführen
ETH Zürich entwickelt kleinste Spritze der Welt

Dunn Labortechnik feiert 30-jähriges Firmenjubiläum

Feinstaub ist gefährlicher als gedacht - Bereits in der Atmosphäre bilden sich gesundheitsschädliche Substanzen, nicht erst im menschlichen Körper
Neu entwickelte, bioinspirierte Zelltransportmittel
Sorge vor Krim-Kongo-Virus - Rostocker Tropenmediziner warnt vor noch schwereren Epidemien als EHEC 2011

Steife Fasern aus Schleim gesponnen - Nanopartikel aus Sekret von Stummelfüßern bilden Polymerfäden, die in Wasser recycelt werden können
Erhebliche Kostenersparnis bei CAR-T-Zell-Therapien möglich - Ein alternatives Verfahren könnte die Herstellungskosten auf ein Zehntel des derzeitigen kommerziellen Preises reduzieren
Malonyl-CoA




















































