Erste molekulare Filme am European XFEL
Forscher verfolgen Dynamik von lichtempfindlichem Protein mit dem europäischen Röntgenlaser
Ein internationales Forscherteam hat den ersten Film von der Dynamik eines Biomoleküls am europäischen Röntgenlaser European XFEL aufgenommen. In einem in „Nature Methods“ veröffentlichten Fachartikel zeigen die Wissenschaftler, wie sich die hohe Wiederholrate der Röntgenpulse am European XFEL effektiv nutzen lässt, um detaillierte molekulare Filme zu erhalten. Diese Art von Information kann helfen, besser zu verstehen, wie zum Beispiel ein Wirkstoffmolekül mit Proteinen in einer menschlichen Zelle reagiert oder wie Pflanzenproteine Lichtenergie speichern. „Das ist ein Schlüsselerfolg für die Erstellung molekularer Filme mit hohem Durchsatz am European XFEL“, betont DESY-Forscher Anton Barty, Ko-Autor des Fachartikels.

Künstlerische Darstellung eines Kristallographie-Serienexperiments. Ein Strom von Proteinkristallen wird zunächst von einem optischen Laser angeregt, bevor er vom Röntgenlaser getroffen wird. Die aufgezeichneten Informationen über die Anordnung der Atome im Protein werden verwendet, um den zeitlichen Verlauf der Proteinstruktur zu rekonstruieren.
European XFEL, Blue Clay Studios
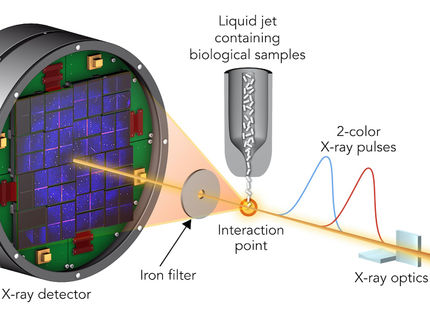
Herkömmliche strukturbiologische Methoden verwenden Röntgenstrahlen, um Momentaufnahmen der dreidimensionalen Struktur von Molekülen, wie zum Beispiel Proteinen, zu erstellen. Diese Informationen offenbaren aber keine Einzelheiten des Ablaufs biomolekularer Prozesse. Werden jedoch mehrere Schnappschüsse in schneller Folge aufgenommen, können diese zu einem sogenannten molekularen Film zusammengesetzt werden. Die hohe Wiederholrate der extrem kurzen Röntgenpulse des European XFEL ermöglicht es, große Datenmengen zu sammeln, um Filme mit einer bislang unerreichten Zahl von Einzelbildern zu produzieren. Eine internationale Forschungsgruppe hat nun herausgefunden, wie sich die sehr hohe Wiederholrate des European XFEL optimal nutzen lässt, um solche molekularen Filme aufzunehmen und neue Details unserer Welt zu enthüllen.
Für diese Art von Experimenten müssen Instrumente und Komponenten sorgfältig ausgerichtet und ihre Eigenschaften genau verstanden sein. In „Nature Methods“ stellen die Wissenschaftler einen Versuchsaufbau vor, der die wertvolle Experimentierzeit optimal nutzt. Sie zeigen, wie Messungen schnell genug nacheinander durchgeführt werden können, um möglichst viele Daten sammeln zu können und gleichzeitig sicherzustellen, dass die zu untersuchende Probe ausschließlich von dem vorgesehenen Laserpuls getroffen wird. „Wir wissen jetzt, wie wir die Pulsstruktur des European XFEL effektiv und effizient nutzen können, um detaillierte molekulare Filme zu erstellen“, erklärte Adrian Mancuso, Leiter der SPB/SFX-Experimentierstation (Single Particles, Clusters, and Biomolecules and Serial Femtosecond Crystallography) am European XFEL, an der die Studie durchgeführt wurde.
Marius Schmidt von der University of Wisconsin-Milwaukee in den USA, der die Untersuchung leitete, betonte: „Die extrem kurzen und hellen Röntgenpulse des European XFEL ermöglichen uns, feinste Details biologischer Prozesse zu untersuchen. Stellen Sie sich einen Film über ein Ski-Abfahrtsrennen vor, der aus nur drei Einzelaufnahmen besteht. Damit erfahren Sie etwas über den Start und das Ende des Rennens und können sich ein Bild des Skifahrers sowie der Landschaft irgendwo am Berg machen, aber viel mehr nicht. Ein Film mit wesentlich mehr Bildern würde das Rennen dagegen im Detail zeigen und wäre viel informativer. Jetzt, da wir verstehen, wie wir die Röntgenpulse des European XFEL nutzen können, um große Datenmengen zu sammeln und detaillierte molekulare Filme zu erzeugen, sind wir sehr gespannt, welche ungeahnten Erkenntnisse nun möglich sind.“
Das Team der SPB/SFX-Experimentierstation kann zudem die Parameter jedes Experiments an das jeweils untersuchte Protein anpassen. Dazu gehören die Änderung des Durchmessers des sichtbaren Laserlichtpulses in Abhängigkeit von der Größe der einzelnen Proteinkristalle und die Anpassung der Zeitverzögerung zwischen diesem Lichtpuls und dem des Röntgenlasers an die Dauer der zu untersuchenden Reaktion. „Das Wissen und die Erfahrung, die wir bei diesen Experimenten am European XFEL gesammelt haben, werden es ermöglichen, an der SPB/SFX-Experimentierstation molekulare Filme von Proben zu produzieren“, erklärte Mancuso.
Für ihre Experimente untersuchten die Forscher ein lichtempfindliches Protein namens photoaktives gelbes Protein (PYP), das häufig als Modellsystem zur Evaluierung neuer Versuchsaufbauten verwendet wird. Soweit bereits bekannt stimmten die neuen Daten mit denjenigen überein, die bei früheren Experimenten an anderen Anlagen gesammelt wurden und bestätigten damit, dass der Versuchsaufbau funktioniert. Die Wissenschaftler konnten zudem aber auch eine bisher unerforschte Zeitspanne erschließen und so neue Details über Teile der biologischen Reaktion enthüllen. „XFELs sind auf einzigartige Weise dafür ausgerüstet, um molekulare Filme von Proteinen in Aktion bei Raumtemperatur zu machen, so wie es hier geschehen ist“, fasst Henry Chapman zusammen, Leitender Wissenschaftler bei DESY und Ko-Autor des Fachartikels.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Proteinanalytik
Die Proteinanalytik ermöglicht einen tiefen Einblick in diese komplexen Makromoleküle, ihre Struktur, Funktion und Wechselwirkungen. Sie ist unerlässlich für die Entdeckung und Entwicklung von Biopharmazeutika, das Verständnis von Krankheitsmechanismen und die Identifizierung von therapeutischen Zielen. Durch Techniken wie Massenspektrometrie, Western Blot und Immunoassays können Forscher Proteine auf molekularer Ebene charakterisieren, ihre Konzentration bestimmen und mögliche Modifikationen identifizieren.

Themenwelt Proteinanalytik
Die Proteinanalytik ermöglicht einen tiefen Einblick in diese komplexen Makromoleküle, ihre Struktur, Funktion und Wechselwirkungen. Sie ist unerlässlich für die Entdeckung und Entwicklung von Biopharmazeutika, das Verständnis von Krankheitsmechanismen und die Identifizierung von therapeutischen Zielen. Durch Techniken wie Massenspektrometrie, Western Blot und Immunoassays können Forscher Proteine auf molekularer Ebene charakterisieren, ihre Konzentration bestimmen und mögliche Modifikationen identifizieren.