Komplexe Organmodelle aus dem Labor
Wissenschaftlern der Universität Würzburg ist es gelungen, aus Alleskönner-Stammzellen im Labor menschliche Gewebe zu erzeugen, die in ihrer Komplexität dem normalen Gewebe sehr nahe kommen und die damit bisherigen Konstrukten überlegen sind. In Zukunft könnten solche Organoide helfen, die Vorgänge bei der Entstehung von Krankheiten besser zu untersuchen und die Wirkung von therapeutischen Substanzen genauer zu analysieren, bevor sie bei Tier und Mensch eingesetzt werden. Außerdem können damit künstliche Gewebe erzeugt werden, die mit einem funktionierenden Blutgefäßsystem ausgestattet sind und somit erfolgreicher in Patienten transplantiert werden könnten.

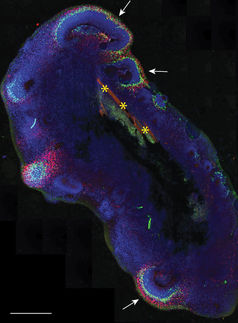
Organoidmodelle mit einer teils verblüffende Ähnlichkeit zu echten embryonalen Geweben. Hier zu sehen sind (v.l.): 3D-Rekonstruktion des Blutgefäßsystems innerhalb eines Organoids, Gehirn-Organoid mit Blutgefäßen (rot) und Gehirnstammzellen (grün) und einTumor-Organoid mit Blutgefäßen (rot) und Tumorzellen (grün).
Institut für Anatomie und Zellbiologie
Seit es japanischen Forschern im Jahr 2006 erstmals gelungen ist, Alleskönner-Stammzellen durch eine epigenetische Umprogrammierung von Bindegewebszellen künstlich herzustellen, steht der Wissenschaft ein unvergleichlich wertvoller Zelltyp zur Verfügung, mit dessen Hilfe sich alle Zellen des menschlichen Körpers in der Kulturschale erzeugen lassen.
Kultiviert man diese sogenannten „induzierten pluripotenten Stammzellen“ (iPS-Zellen) als dreidimensionale Zellaggregate, lassen sich durch die gezielte Zugabe von Wachstumsfaktoren funktionierende Miniaturversionen menschlicher Organe erschaffen, sogenannte Organoide. Basierend auf dieser Technik wurden innerhalb der letzten Jahre beispielsweise Zellkulturmodelle des Darms, der Lunge, der Leber, der Nieren sowie des Gehirns erschaffen.
Bisherige Organoide blieben unvollständig
Solche Organoidmodelle weisen eine teils verblüffende Ähnlichkeit zu echten embryonalen Geweben auf. Allerdings blieben sie, bedingt durch die Herstellungsmethode, bisher meist unvollständig, da sie keine Zellen und Strukturen des Organstroma – des bindegewebigen Stützgerüstes – enthielten. Es fehlten beispielsweise Blutgefäße und Immunzellen. Während der Embryonalentwicklung stehen all diese Zelltypen und Strukturen jedoch in ständigem Austausch und treiben durch gegenseitige Beeinflussung die Entwicklung und Reifung des Gewebes sowie des Organs voran. Auch Erkrankungen entstehen meist im Gewebekontext unter Beteiligung verschiedener Zelltypen.
Ein gezielter Einbau dieser Stromakomponenten und besonders von funktionierenden Blutgefäßen würde daher bereits etablierte Organoidmodelle besser ausreifen lassen und eine Krankheitsmodellierung realistischer gestalten beziehungsweise für manche Erkrankungen überhaupt erst möglich machen. Außerdem könnten künstliche Gewebe mit einem bereits ausgereiften Blutgefäßsystem erfolgreicher transplantiert werden. Darüber hinaus bieten komplexe Organoide eine einmalige Möglichkeit, Aspekte der Entstehung menschlicher Organe im Labor zu beobachten und zu verstehen. Weil sich an ihnen neue pharmakologische Wirkstoffe gut testen lassen, können sie außerdem dazu beitragen, die Zahl von Tierversuchen zu reduzieren.
Mesodermale Stammzellen vervollständigen Miniorgane
Ein wichtiger Schritt auf dem Weg zu solch komplexen Organoiden ist jetzt Wissenschaftlern der Julius-Maximilians-Universität Würzburg (JMU) gelungen. Verantwortlich dafür waren die Anatomen Dr. Philipp Wörsdörfer und Professor Süleyman Ergün, Vorstand des Instituts für Anatomie und Zellbiologie. Dabei bedienten sie sich eines Tricks: Sie erzeugten aus Alleskönner-Stammzellen zunächst sogenannte mesodermale Vorläuferzellen. Diese Zellen können unter geeigneten Bedingungen Blutgefäße, Immunzellen sowie die Zellen des Bindegewebes hervorbringen.
Um das Potenzial der mesodermalen Vorläufer zu demonstrieren, mischten die Wissenschaftler diese Zellen zum einen mit Tumorzellen und zum anderen mit Gehirnstammzellen, die wiederum zuvor von humanen iPS-Zellen generiert worden waren. Aus dieser Mischung entwickelten sich in der Zellkulturschale komplexe dreidimensionale Tumor- beziehungsweise Hirnorganoide mit funktionellen Blutgefäßen, Bindegewebsanteilen und im Falle des Hirngewebes auch hirnspezifischen Immunzellen, sogenannten Mikroglia-Zellen.